
Istoria teoriei cinetice moleculare, postulate și exemple

teoria cinetică moleculară Este una care încearcă să explice observațiile experimentale ale gazelor dintr-o perspectivă microscopică. Adică încearcă să asocieze natura și comportamentul particulelor gazoase, cu caracteristicile fizice ale gazului ca fluid; explica macroscopicul de la microscopic.
Gazele au fost întotdeauna de interes pentru oamenii de știință datorită proprietăților lor. Acestea ocupă întregul volum al containerului în care se găsesc, putând fi complet comprimate fără ca conținutul lor să se opună celei mai mici rezistențe; iar dacă temperatura crește, recipientul începe să se extindă și poate chiar să crape.
Multe dintre aceste proprietăți și comportamente sunt rezumate în legile gazelor ideale. Cu toate acestea, ei consideră gazul ca un întreg și nu ca o colecție de milioane de particule împrăștiate în spațiu; Mai mult, nu oferă, pe baza datelor de presiune, volum și temperatură, informații suplimentare cu privire la modul în care se mișcă aceste particule.
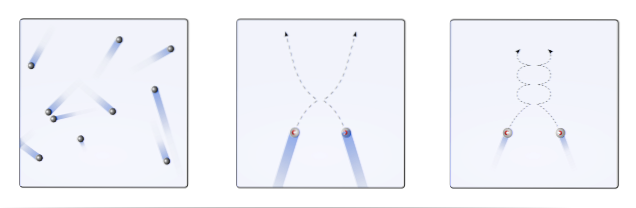
Astfel, teoria cinetică moleculară (TCM) propune vizualizarea lor ca sferă mobilă (imagine superioară). Aceste sfere se ciocnesc între ele și pereții în mod arbitrar și mențin o traiectorie liniară. Cu toate acestea, atunci când temperatura scade și presiunea crește, traiectoria sferelor devine curbată..
Un gaz, conform TCM, ar trebui să se comporte ca sferele din primul cadru al imaginii. Dar, prin răcire și creșterea presiunii asupra lor, comportamentul lor este departe de a fi ideal. Sunt apoi gaze reale, aproape de a fi lichefiate și astfel trec în faza lichidă.
În aceste condiții, interacțiunile dintre sfere devin mai importante, până la punctul în care viteza lor încetinește momentan. Cu cât sunt mai aproape de lichefiere, cu atât traiectoriile lor devin mai curbate (inserate în dreapta) și cu cât coliziile lor sunt mai puțin energice..
Indice articol
- 1 Istorie
- 1.1 Daniel Bernoulli
- 1.2 Rudolf Clausius
- 1.3 James Clerk Maxwell și Ludwig Boltzmann
- 2 Postulate ale teoriei cinetice moleculare
- 2.1 Volumul particulelor gazoase este neglijabil
- 2.2 Forțele de atracție dintre particule sunt nule
- 2.3 Particulele gazoase sunt întotdeauna în mișcare
- 2.4 Coliziunile dintre particule și pereții containerului sunt elastice
- 2.5 Energia cinetică nu rămâne constantă
- 2.6 Energia cinetică medie este egală cu o temperatură dată pentru toate gazele
- 3 Exemple
- 3.1 Legea lui Boyle
- 3.2 Legea lui Charles
- 3.3 Legea lui Dalton
- 4 Referințe
Poveste
Daniel Bernoulli
Ideea acestor sfere, mai bine numite atomi, fusese deja luată în considerare de filosoful roman Lucretius; nu pentru gaze, ci pentru obiecte statice solide. Pe de altă parte, în 1738 Daniel Bernoulli a aplicat viziunea atomică asupra gazelor și lichidelor, imaginându-le ca sfere dezordonate care se mișcă în toate direcțiile..
Opera sa, cu toate acestea, a încălcat legile fizicii la acea vreme; un corp nu se putea mișca etern, așa că era imposibil să ne gândim că un set de atomi și molecule se vor ciocni unul cu celălalt fără a-și pierde energia; adică nu a fost posibilă existența coliziunilor elastice.
Rudolf clausius
Un secol mai târziu, alți autori au întărit TCM cu un model în care particulele gazoase s-au deplasat într-o singură direcție. Cu toate acestea, Rudolf Clausius și-a compilat rezultatele și a pus la punct un model TCM mai complet cu care a încercat să explice legile ideale ale gazelor demonstrate de Boyle, Charles, Dalton și Avogadro..
James Clerk Maxwell și Ludwig Boltzmann
În 1859, James Clerk Maxwell a declarat că particulele gazoase prezintă o gamă de viteze la o anumită temperatură și că un set dintre ele poate fi considerat prin intermediul unei viteze moleculare medii..
Apoi, în 1871, Ludwig Boltzmann a conectat ideile existente cu entropia și modul în care gazul termodinamic tinde întotdeauna să ocupe cât mai mult spațiu posibil în mod omogen și spontan.
Postulatele teoriei cinetice moleculare
Pentru a lua în considerare gazul din particulele sale, este necesar un model în care sunt îndeplinite anumite postulate sau ipoteze; postulează că în mod logic trebuie să fie capabil să prezică și să explice (cât mai exact posibil) observațiile macroscopice și experimentale. Acestea fiind spuse, postulatele TCM sunt menționate și descrise.
Volumul particulelor gazoase este neglijabil
Într-un recipient umplut cu particule gazoase, acestea se dispersează și se îndepărtează unul de celălalt în toate colțurile. Dacă pentru o clipă toate puteau fi reunite într-un anumit punct al containerului, fără lichefiere, s-ar observa că acestea ocupă doar o porțiune neglijabilă din volumul containerului..
Înseamnă că recipientul, chiar dacă conține milioane de particule gazoase, este de fapt mai gol decât plin (raportul volum-vid mult mai mic de 1); prin urmare, dacă barierele sale permit acest lucru, acesta și gazul din interiorul acestuia pot fi comprimate brusc; deoarece la sfârșitul zilei particulele sunt foarte mici, la fel și volumul lor.
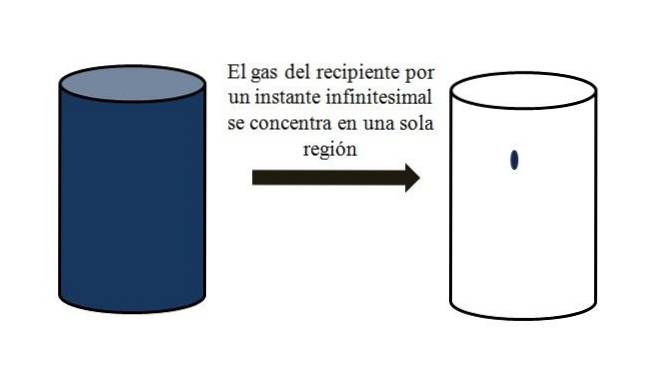
Imaginea superioară ilustrează cu precizie cele de mai sus, folosind un gaz de culoare albăstruie.
Forțele de atracție dintre particule sunt zero
Particulele gazoase din interiorul containerului se ciocnesc între ele fără suficient timp pentru ca interacțiunile lor să câștige forță; cu atât mai puțin când ceea ce le înconjoară în principal este vidul molecular. O consecință imediată a acestui fapt este că traseele lor liniare le permit să cuprindă complet volumul containerului..
Dacă nu ar fi cazul, un container cu o formă „bizară” și „labirintică” ar avea regiuni umede ca urmare a condensării gazului; în schimb, particulele se deplasează în jurul containerului cu deplină libertate, fără ca forța interacțiunilor lor să le oprească.
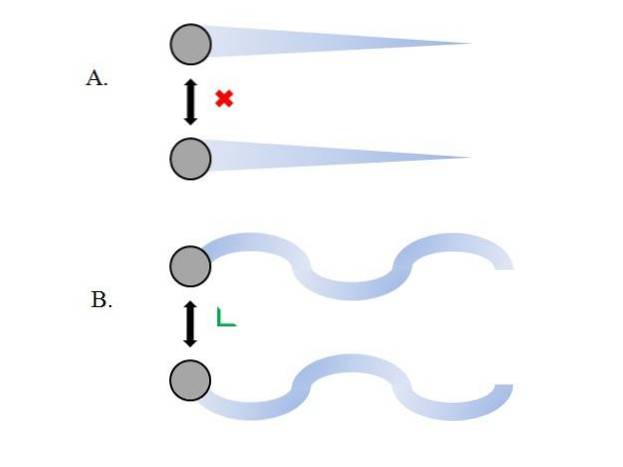
Traiectoriile liniare ale imaginii superioare (A.) demonstrează acest postulat; în timp ce dacă traiectoriile sunt curbate (B.), arată că există interacțiuni care nu pot fi ignorate între particule.
Particulele gazoase sunt întotdeauna în mișcare
Din primele două postulate converge și faptul că particulele de gaz nu se opresc niciodată din mișcare. Odată estompate în recipient, ele se ciocnesc între ele și cu pereții acestuia, cu o forță și viteză direct proporționale cu temperatura absolută; această forță este presiunea.
Dacă particulele gazoase nu se mai mișcau pentru o clipă, „limbile de fum” ar fi observate în interiorul containerului, ieșind din nicăieri, cu suficient timp pentru a se aranja în vid și pentru a da forme aleatorii..
Coliziunile dintre particule și pereții recipientului sunt elastice
Dacă numai coliziuni elastice între particulele gazoase și pereții recipientului predomină în interiorul recipientului, condensarea gazului nu va avea loc niciodată (atâta timp cât condițiile fizice nu se schimbă); sau ceea ce este același lucru cu a spune că nu se odihnesc niciodată și se ciocnesc întotdeauna.
Acest lucru se datorează faptului că în coliziunile elastice nu există pierderi nete de energie cinetică; o particulă se ciocnește de perete și sare în aceeași viteză. Dacă o particulă la coliziune încetinește, cealaltă accelerează, fără a produce căldură sau sunet care disipă energia cinetică a uneia dintre ele.
Energia cinetică nu rămâne constantă
Mișcarea particulelor este aleatorie și haotică, astfel încât acestea să nu aibă toate aceeași viteză; la fel cum se întâmplă, de exemplu, pe o autostradă sau în mulțime. Unele sunt mai energice și călătoresc mai repede, în timp ce altele sunt lente, așteptând o coliziune pentru a le accelera.
Pentru a descrie viteza sa, este necesar să se calculeze o medie; și cu aceasta, energia cinetică medie a particulelor sau moleculelor gazoase se obține pe rând. Deoarece energia cinetică a tuturor particulelor se schimbă constant, media permite un control mai bun al datelor și poate fi lucrat cu o fiabilitate mai mare..
Energia cinetică medie este egală cu o temperatură dată pentru toate gazele
Energia cinetică moleculară medie (ECmp) într-un recipient se schimbă cu temperatura. Cu cât temperatura este mai mare, cu atât energia va fi mai mare. Deoarece este o medie, pot exista particule sau gaze care au o energie mai mare sau mai mică decât această valoare; unele mai rapide, respectiv altele mai lente.
Matematic se poate arăta că ECmp depinde exclusiv de temperatură. Aceasta înseamnă că, indiferent de gaz, de masa sau de structura moleculară, de CEmp va fi la fel la o temperatură T și va varia doar dacă crește sau scade. Dintre toate postulatele, acesta este poate cel mai relevant..
Și ce zici de viteza moleculară medie? Spre deosebire de CEmp, masa moleculară influențează viteza. Cu cât particula sau molecula gazoasă este mai grea, este firesc să ne așteptăm să se miște mai încet..
Exemple
Iată câteva exemple scurte despre modul în care TCM a reușit să explice legile ideale privind gazele. Deși nu sunt abordate, alte fenomene, cum ar fi difuzia și revărsarea gazelor, pot fi explicate și cu TCM.
Legea lui Boyle
Dacă volumul recipientului este comprimat la temperatură constantă, distanța pe care particulele gazoase trebuie să o parcurgă pentru a se ciocni cu pereții scade; ceea ce este egal cu o creștere a frecvenței unor astfel de coliziuni, rezultând o presiune mai mare. Deoarece temperatura rămâne constantă, ECmp este, de asemenea, constantă.
Charles Law
Dacă creșteți T, ECmp va creste. Particulele gazoase se vor mișca mai repede și vor ciocni de mai multe ori cu pereții containerului; deci presiunea crește.
Dacă pereții sunt flexibili, capabili să se extindă, suprafața lor va deveni mai mare și presiunea va scădea până când va deveni constantă; și, ca urmare, volumul va crește, de asemenea.
Legea lui Dalton
Dacă la un recipient spațios s-ar adăuga câțiva litri de gaze diferite, provenind din recipiente mai mici, presiunea sa totală internă ar fi egală cu suma presiunilor parțiale exercitate de fiecare tip de gaz separat..
De ce? Deoarece toate gazele încep să se ciocnească între ele și să se disperseze omogen; interacțiunile dintre ele sunt nule, iar vidul predomină în container (postulează TCM), deci este ca și cum fiecare gaz ar fi singur, exercitându-și presiunea individual fără interferența celorlalte gaze.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Learning, P 426-431.
- Fernandez Pablo. (2019). Teoria cinetică moleculară. Vix. Recuperat de pe: vix.com
- Jones, Andrew Zimmerman. (7 februarie 2019). Teoria moleculară cinetică a gazelor. Recuperat de pe: thoughtco.com
- Sala Nancy. (5 mai 2015). Teoria cinetică a gazelor. Centrul de cercetare Glenn. Recuperat de la: grc.nasa.gov
- Blaber M. & Lower S. (09 octombrie 2018). Bazele teoriei moleculare cinetice. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Teoria moleculară cinetică. Recuperat de la: chemed.chem.purdue.edu
- Wikipedia. (2019). Teoria cinetică a gazelor. Recuperat de pe: en.wikipedia.org
- Toppr. (s.f.). Teoria moleculară cinetică a gazelor. Recuperat de pe: toppr.com


Nimeni nu a comentat acest articol încă.