
Proprietăți, structură, utilizări ale oxidului de clor (V)
oxid de clor (V) este un compus anorganic extrem de instabil a cărui formulă chimică este ClDouăSAU5. Este unul dintre mulți oxizi de clor, care se caracterizează prin faptul că sunt specii moleculare sau chiar radicale.
ClDouăSAU5 A găsit viață doar în hârtie și în calcule teoretice; cu toate acestea, existența sa nu a fost exclusă și este probabil ca unele să fie caracterizate (prin tehnici avansate de spectroscopie). Ceea ce poate fi prezis din conceptele de chimie generală ale acestui oxid este că este anhidrida acidului cloric, HClO3.
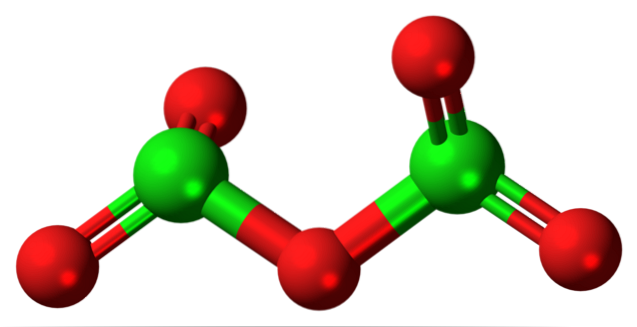
Molecula ipotetică de oxid de clor (V) este prezentată mai sus. Rețineți că, deoarece este o moleculă, prezența ionului Cl nu este deloc luată în considerare+5; cu atât mai puțin atunci când trebuie să aibă o astfel de putere de polarizare pentru a forța oxigenul să se lege covalent.
La fel ca toți compușii instabili, eliberează energie pentru a se descompune în produse mai stabile; proces care în multe cazuri este exploziv. Când clDouăSAU5 descompune eliberări ClODouă pe mineDouă. Se teorizează că în apă, în funcție de izomerul ClDouăSAU5, poate forma diverși oxoacizi de clor.
Indice articol
- 1 Proprietăți
- 2 Structura oxidului de clor (V)
- 2.1 Molecula
- 2.2 Structura lui Lewis
- 2.3 Izomerii și hidroliza lor respectivă
- 3 Nomenclatură
- 4 utilizări
- 5 Referințe
Proprietăți
Masa molară a ClDouăSAU5 este de 150,9030 g / mol. Din această masă și din molecula sa ipotetică, se poate presupune că, dacă ar putea fi izolată, ar fi probabil un lichid uleios; desigur, comparându-l cu aspectul fizic al ClDouăSAU7.
Deși nu poate fi izolat sau caracterizat, acest oxid de clor este acid, covalent și trebuie să aibă, de asemenea, un moment dipol mic. Aciditatea sa este de înțeles dacă se analizează ecuația chimică a hidrolizei sale:
ClDouăSAU5 + HDouăO 2HClO3
Fiind HClO3 acid cloric. Reacția inversă ar rezulta în cazul în care acidul poate fi deshidratat:
2HClO3 => ClDouăSAU5 + HDouăSAU
Pe de altă parte, când ClDouăSAU5 greu produs, se descompune:
2ClDouăSAU5 => 4ClODouă + SAUDouă
Prin urmare, este mai degrabă o specie intermediară decât un oxid vorbind corect. Descompunerea sa trebuie să fie atât de rapidă (având în vedere că chiar și ClDouăSAU5), care nu a fost detectat de tehnicile actuale de analiză instrumentală.
Structura oxidului de clor (V)
Moleculă
În imaginea superioară, a fost arătată structura moleculei ipotetice de Cl.DouăSAU5 cu un model de sfere și bare. Sferele roșii reprezintă atomi de oxigen, iar sferele verzi reprezintă atomi de clor. Fiecare clor are un mediu piramidal trigonal, deci hibridizarea acestuia trebuie să fie sp3.
Astfel, molecula de ClDouăSAU5 poate fi văzut ca două piramide trigonale legate de un oxigen. Dar dacă priviți cu atenție, o piramidă își orientează atomii de oxigen în jos, cealaltă în afara planului (spre cititor)..
Prin urmare, se presupune că există rotații în legătura O.DouăCl-O-ClODouă, făcând molecula relativ dinamică. Rețineți că formula ODouăCHLOClODouă este un mod de a reprezenta structura lui ClDouăSAU5.
Structura lui Lewis
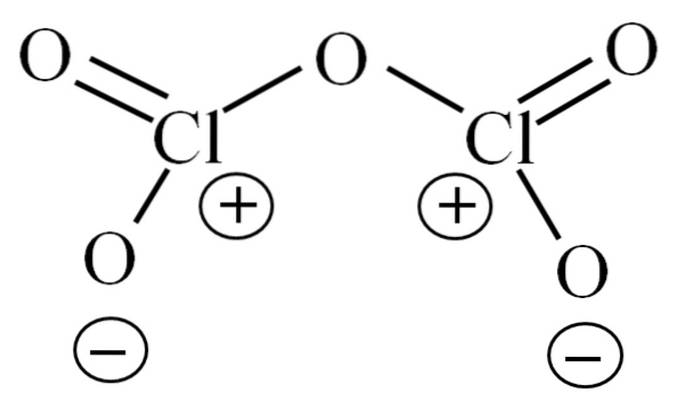
Până acum, molecula de la sine nu a făcut posibilă descifrarea din cauza instabilității sale. Pentru a face lumină asupra acestei întrebări, ne îndreptăm spre structura lui Lewis, descrisă mai sus. Rețineți că structura poate fi considerată greșit că este plană, dar în subsecțiunea anterioară s-a clarificat că nu este cazul..
De ce ambii atomi de clor au sarcini formale pozitive? Deoarece clorului îi mai rămâne o pereche liberă de electroni, care poate fi verificată prin aplicarea teoriei Valencia Bond (care nu se va face aici în scopuri de simplificare). Astfel, sarcina sa formală este:
CF = 7 - (4 + 2) = 1
Și ce legătură are asta cu instabilitatea lor? Ei bine, clorul este considerabil electronegativ și, prin urmare, este un purtător slab de sarcini formale pozitive. Aceasta revine la ClDouăSAU5 o specie foarte acidă, deoarece trebuie să câștige electroni pentru a furniza cererea electronică pentru cei doi clori.
Opusul se întâmplă cu BrDouăSAU5 iar euDouăSAU5, oxizi care există în condiții normale. Acest lucru se datorează faptului că atât bromul, cât și iodul sunt mai puțin electronegative decât clorul; și, prin urmare, susțin mai bine sarcina formală pozitivă.
Izomerii și hidroliza lor respectivă
Până acum întreaga explicație a căzut asupra unuia dintre cei doi izomeri ai ClDouăSAU5: ODouăCHLOClODouă. Care este cealaltă? O3CHLOClO. În acest izomer clorii nu au sarcini pozitive formale și, prin urmare, ar trebui să fie o moleculă mai stabilă. Cu toate acestea, atât ODouăCHLOClODouă ca O3ClOClO trebuie să sufere reacții de hidroliză:
SAUDouăCl-O-ClODouă + HDouăO => 2ODouăCl-OH (care nu sunt altceva decât HClO3)
SAU3Cl-O-ClO + HDouăO => O3Cl-OH (HClO4) + HO-ClO (HClODouă)
Rețineți că se pot forma până la trei clor oxoacizi: HClO3, HClO4 și HClODouă
Nomenclatură
Denumirea sa „oxid de clor (V)” corespunde cu cea atribuită în conformitate cu nomenclatura stocului. ClDouăSAU5 Poate avea, de asemenea, alte două denumiri: dicloro pentaoxid și anhidridă clorică, atribuite de nomenclaturile sistematice și respectiv tradiționale..
Aplicații
Mai mult decât studii computaționale motivante, ClDouăSAU5 Nu va fi utilizat până când nu va fi descoperit, izolat, caracterizat, depozitat și arătat că nu explodează la cel mai mic contact..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Sandra Luján Quiroga și Luis José Perissinotti. (2011). Oxoacizi de clor și structura oxizilor de diclor. Chem. Educator, Vol. 16.
- Formulare chimică. (2019). Oxid de clor (V). Recuperat de pe: formulacionquimica.com
- Linus Pauling. (1988). Chimie generală. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Enciclopedia compușilor alcalini ai pământului. Elsevier.

Nimeni nu a comentat acest articol încă.