
Motivarea, tehnicile și utilizările colorării sporilor

colorarea sporilor Este metodologia utilizată pentru a colora structurile de rezistență care formează unele genuri bacteriene atunci când se află în condiții nefavorabile; aceste structuri corespund unei forme de supraviețuire.
Există multe genuri care formează spori; cu toate acestea, principalele sunt Bacillus și Clostridium. Aceste genuri sunt considerate mai relevante deoarece au specii patogene pentru oameni..
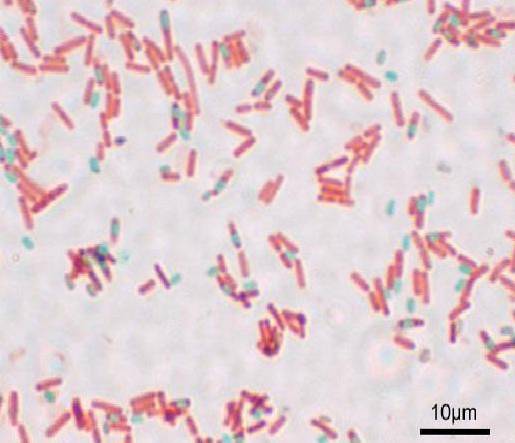
Fiecare bacil poate da naștere unui spor. La momentul colorării preparatului, sporul poate fi găsit în bacil (endospor) sau în afara acestuia (exospor). Cu tehnicile convenționale de colorare pentru bacterii - cum ar fi colorarea Gram - sporii rămân incolori.
În prezent, există mai multe metodologii de colorare care sunt capabile să pătrundă în structura groasă a sporului pentru a o vopsi. Aceste metodologii sunt foarte variate; Acestea includ tehnica Dorner, pata Möeller și metodologia Shaeffer-Fulton, cunoscută și sub numele de Wirtz-Conklin..
Dintre toate tehnicile menționate, metodologia Shaeffer-Fulton este cea mai utilizată în laboratoarele de rutină. Acesta poartă numele după doi microbiologi care au creat culoarea în 1930: Alicia Shaeffer și MacDonald Fulton. Cu toate acestea, tehnica este uneori numită Wirtz-Conklin în onoarea a doi bacteriologi din anii 1900..
Indice articol
- 1 Justificare
- 2 Tehnici de colorare a sporilor
- 2.1 Tehnica Dorner
- 2.2 Tehnica Dorner modificată
- 2.3 Tehnica Shaeffer-Fulton sau Wirtz-Conklin
- 2.4 Tehnica Möeller
- 2.5 Tehnica Möeller modificată fără căldură
- 3 utilizări
- 3.1 Exemple
- 4 Referințe
Bază
Sporii nu se colorează cu pete convenționale, deoarece au un perete foarte gros. Compoziția complexă a sporilor împiedică intrarea majorității coloranților.
Dacă sporul este studiat din exterior în interior, se observă următoarele straturi: primul este exosporium, care este cel mai subțire și exterior strat format din glicoproteine.
Urmează cuticula, care oferă rezistență la temperaturi ridicate, urmată de cortexul compus din peptidoglican. Mai târziu este peretele bazei care protejează protoplastul.
Sporul este o structură deshidratată care conține 15% calciu și acid dipicolinic. Din acest motiv, majoritatea tehnicilor de colorare a sporilor se bazează pe aplicarea căldurii, astfel încât colorantul să poată pătrunde în structura groasă..
Odată ce sporul este colorat, nu mai poate îndepărta colorantul. În tehnica Shaeffer-Fulton, verdele de malachit intră în celulele vegetative și, atunci când se aplică căldură, pătrunde și în endospor și în exospori..
Prin spălarea cu apă, colorantul este îndepărtat din celula vegetativă. Acest lucru se întâmplă deoarece colorantul verde malachit este ușor de bază, deci se leagă slab de celula vegetativă..
În schimb, nu poate ieși din spori și bacilul este în cele din urmă contracolorat cu safranină. Această fundație este valabilă pentru restul tehnicilor, în care se întâmplă ceva similar.
Tehnici de colorare a sporilor
Pentru a efectua colorarea sporilor, trebuie să aveți o cultură pură a tulpinii suspecte pe care doriți să o studiați..
Cultura este supusă la temperaturi extreme timp de 24 de ore pentru a stimula microorganismul să sporeze. Pentru aceasta, cultura poate fi plasată într-un cuptor la 44 ° C sau la frigider (8 ° C) timp de 24 sau 48 de ore..
Dacă se lasă prea mult la temperaturile menționate, vor fi observați numai exospori, deoarece toți endosporii vor fi părăsit deja bacilul.
La sfârșitul timpului, câteva picături de soluție fiziologică sterilă ar trebui așezate pe o lamă curată. Apoi se ia o mică porțiune din cultură și se face o răspândire fină.
Se lasă apoi să se usuce, se pune la căldură și se vopsește cu una dintre tehnicile explicate mai jos:
Tehnica Dorner
1- Pregătiți o suspensie concentrată a microorganismului sporulat în apă distilată într-o eprubetă și adăugați un volum egal de Kinyoun carbol fuchsin filtrat.
2- Puneți tubul într-o baie de apă clocotită timp de 5 până la 10 minute.
3- Pe o lamă curată, amestecați o picătură din suspensia anterioară cu o picătură de soluție apoasă de nigrosină 10%, fiartă și filtrată..
4- Răspândiți și uscați rapid cu căldură ușoară.
5- Examinează cu un obiectiv 100X (imersiune).
Sporii colorează roșu și celulele bacteriene apar aproape incolore pe un fundal gri închis.
Tehnica Dorner modificată
1- O suspensie a microorganismului sporulat este răspândită pe o lamă și fixată în căldură.
2- Proba este acoperită cu o bandă de hârtie de filtru la care se adaugă fuchsină carbolică. Colorantul este încălzit timp de 5 până la 7 minute cu flacăra arzătorului Bunsen până când se generează evoluția vaporilor. Apoi, hârtia este îndepărtată.
3- Preparatul se spală cu apă și apoi se usucă cu hârtie absorbantă.
4- Acoperiți frotiul cu o peliculă subțire de 10% nigrosină, folosind o a doua lamă pentru a răspândi nigrosina sau un ac.
Culoarea pe care o iau sporii și bacteriile este aceeași cu cea descrisă în stadiul tehnicii.
Tehnica Shaeffer-Fulton sau Wirtz-Conklin
1- Faceți un frotiu fin cu o suspensie a microorganismului sporulat pe o lamă și fixați-l la încălzire.
2- Acoperiți diapozitivul cu soluție apoasă 5% verde malachit (se poate pune o hârtie de filtru pe diapozitiv).
3- Încălziți peste flacăra arzătorului Bunsen pentru a provoca eliberarea vaporilor și îndepărtați flacăra. Repetați operația timp de 6 până la 10 minute. Dacă soluția verde de malachit se evaporă prea mult în timpul procedurii, mai mult.
4- Scoateți hârtia de filtru (dacă este instalată) și spălați-o cu apă.
5- Acoperiți diapozitivul cu 0,5% safranină apoasă timp de 30 de secunde (unele variante ale tehnicii utilizează 0,1% safranină apoasă și lăsați-o timp de 3 minute).
Cu această tehnică sporii apar verzi, iar bacilii roșii..
Are dezavantajul că endosporii culturilor tinere nu se colorează bine, deoarece apar extrem de limpezi sau incolori. Pentru a evita acest lucru, se recomandă utilizarea culturilor de 48 de ore de incubație..
Tehnica Möeller
1- Acoperiți frotiul cu cloroform timp de 2 minute.
2- Aruncați cloroformul.
3- Acoperiți cu 5% acid crom timp de 5 minute.
4- Se spală cu apă distilată
5- Foaia este acoperită cu carbol fuchsin-fenicada și expusă la flacăra arzătorului Bunsen până la emisia de vapori; apoi se scoate din flacără câteva clipe. Operația se repetă până la finalizarea a 10 minute.
6- Se spală cu apă.
7- Folosiți etanol acidificat (alcool clorhidric) pentru a decolora. Se lasă 20 sau 30 de secunde.
8- Se spală cu apă distilată.
9- Contrastinați acoperind foaia cu albastru de metilen timp de 5 minute.
10- Se spală cu apă distilată.
11- Lăsați-l să se usuce și duceți proba la microscop.
Sporii apar roșii, iar bacilii albastri. Este important să nu respirați vaporii, deoarece sunt toxici și pe termen lung pot fi cancerigeni..
Tehnica Möeller modificată fără căldură
În 2007, Hayama și colaboratorii săi au creat o modificare a tehnicii Möeller. Au eliminat etapa de încălzire a colorantului și l-au înlocuit prin adăugarea a 2 picături de surfactant Tergitol 7 pentru fiecare 10 ml de soluție de carbol fuchsin-carbol. Au fost obținute aceleași rezultate.
Aplicații
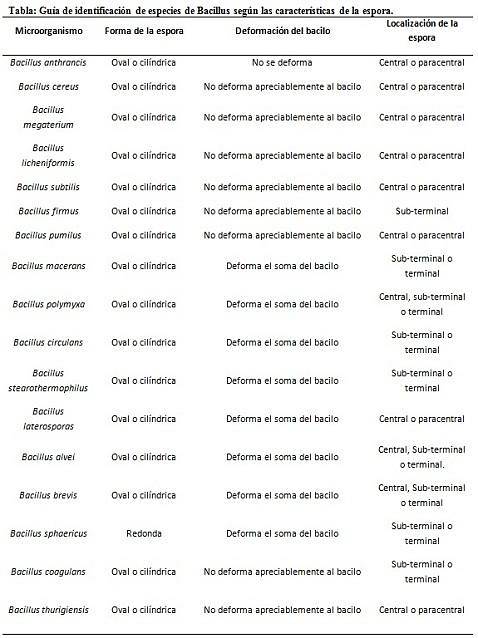
Colorarea sporilor oferă informații foarte valoroase și utile pentru identificarea agentului patogen, deoarece prezența sa, forma sa, localizarea în bacil și capacitatea de a deforma sau nu celula vegetativă sunt date care pot ghida speciile. anumit gen.
În acest context, merită spus că sporii pot fi rotunzi sau ovali, pot fi localizați în centru sau, de asemenea, într-o poziție paracentrală, subminală sau terminală..
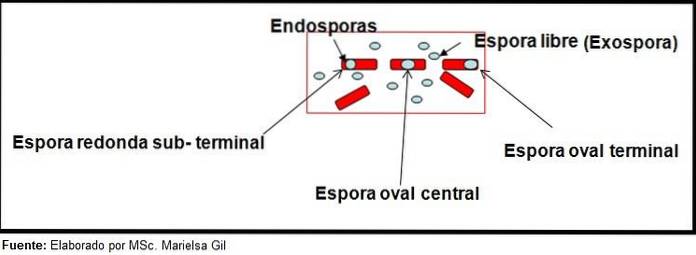
Exemple
- Clostridium difficile formează un spor oval în poziție terminală care deformează bacilul.
- Sporul de Clostridium terțiu este oval, nu deformează bacilul și este situat la nivelul terminal.
- Endosporul din Clostridium tetani este terminal și deformează bacilul, dând aspectul unei tobe.
- Sporii de Clostridium botulinum, C. histolyticum, C. novy Da C. septicum sunt subterminale rotunde sau ovale și deformează bacilul.
- Endosporul din Clostridium sordelli este situat în poziția centrală, cu o ușoară deformare.
Referințe
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Propunerea unei tehnici simplificate pentru colorarea sporilor bacterieni fără aplicarea modificării cu succes a metodei lui Moeller. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Colaboratori Wikipedia. Pata Moeller. Wikipedia, enciclopedia gratuită. 3 noiembrie 2018, 03:28 UTC. Disponibil la: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Manual de laborator pentru tehnici microbiologice. Departamentul de Științe de Bază Academia de Microbiologie. Institutul Politehnic Național.
- „Endospor”. Wikipedia, enciclopedia gratuită. 25 februarie 2018, 10:20 UTC. 10 ianuarie 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J și colaboratori. (2006). Personalul muncii din comunitatea autonomă Extremadura. Agenda specifică Volumul IV. Editorial MAD. Sevilla-Spania, pp. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Tehnician specialist de laborator, Serviciul de Sănătate din Galicia (SERGAS). Subiect specific agenda volumului 2. Editorial MAD. Sevilla-Spania, pp. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosticul microbiologic. (Ed. A 5-a). Argentina, Editorial Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnosticul microbiologic Bailey & Scott. 12 ed. Argentina. Editorial Panamericana S.A



Nimeni nu a comentat acest articol încă.