
Ce este o legătură covalentă de coordonate? (cu exemple)

A legătură covalentă coordonată sau legătură de coordonare esteun tip de legătură în care unul dintre atomii atașați furnizează toți electronii împărțiți.
Într-o legătură covalentă simplă, fiecare atom furnizează un electron legăturii. Pe de altă parte, într-o legătură de coordonare, atomii care donează electronul pentru a forma o legătură sunt numiți atom donator, în timp ce atomul care acceptă perechea de electroni pentru a se uni este numit atom acceptor (Clark, 2012)..
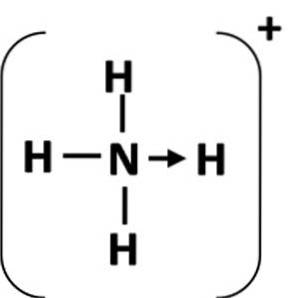
O legătură de coordonare este reprezentată de o săgeată care începe de la atomii donator și se termină la atomul acceptor (Figura 1). În unele cazuri, donatorul poate fi o moleculă.
În acest caz, un atom din moleculă poate dona perechea de electroni, care ar fi baza Lewis, în timp ce molecula cu capacitatea de acceptor ar fi acidul Lewis (Coordonată legătură covalentă, S.F.).
O legătură de coordonare are caracteristici similare cu cea a unei legături covalente simple. Compușii care au acest tip de legătură au în general un punct de topire și fierbere scăzut, cu o interacțiune coulombică inexistentă între atomi (spre deosebire de legătura ionică) și compușii sunt foarte solubili în apă (Atkins, 2017).
Câteva exemple de legături covalente coordonate
Cel mai comun exemplu de legătură de coordonare este ionul de amoniu, care este format din combinația unei molecule de amoniac și a unui proton dintr-un acid.
În amoniac, atomul de azot are o pereche solitară de electroni după finalizarea octetului său. Donați această pereche solitară la ionul hidrogen, astfel atomul de azot devine donator. Atomul de hidrogen devine acceptor (Schiller, S.F.).
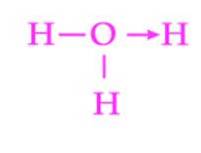
Un alt exemplu comun de legătură dativă este formarea ionului hidroniu. Ca și în cazul ionului de amoniu, perechea de electroni liberi a moleculei de apă servește ca donator la protonul care este acceptorul (figura 2)..
Cu toate acestea, trebuie remarcat faptul că odată ce legătura de coordonare a fost stabilită, toți hidrogenii atașați oxigenului sunt exact echivalenți. Când un ion hidrogen se descompune din nou, nu există discriminare între care dintre hidrogeni este eliberat.
Un exemplu excelent de reacție acid-bază Lewis, care ilustrează formarea unei legături covalente coordonate, este reacția de formare a aductului de trifluorură de bor cu amoniac..
Trifluorura de bor este un compus care nu are o structură de gaz nobil în jurul atomului de bor. Borul are doar 3 perechi de electroni în învelișul său de valență, astfel încât se spune că BF3 este deficitar de electroni.
Perechea electronică nepartajată de azot amoniacal poate fi utilizată pentru a depăși această deficiență și se formează un compus care implică o legătură de coordonare..
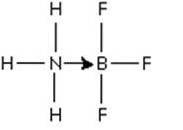
Această pereche de electroni din azot este donată orbitului p gol al borului. Aici amoniacul este baza Lewis și BF3 este acidul Lewis.
Chimie de coordonare
Există o ramură a chimiei anorganice dedicată exclusiv studiului compușilor care formează metale de tranziție. Aceste metale se alătură altor atomi sau molecule prin legături de coordonare pentru a forma molecule complexe..
Aceste molecule sunt cunoscute sub numele de compuși de coordonare și știința care le studiază se numește chimie de coordonare..
În acest caz, substanța legată de metal, care ar fi donatorul de electroni, este cunoscută sub numele de ligand, iar compușii de coordonare sunt cunoscuți în mod obișnuit ca complexe..
Compușii de coordonare includ substanțe precum vitamina B12, hemoglobină și clorofilă, coloranți și pigmenți și catalizatori folosiți la prepararea substanțelor organice (Jack Halpern, 2014).
Un exemplu de ion complex ar fi complexul cobalt [Co (NHDouăCHDouăCHDouăNHDouă) 2ClNH3]Două+ care ar fi dicloroaminetilendiamina cobalt (IV).
Chimia coordonării a rezultat din activitatea lui Alfred Werner, un chimist elvețian care a examinat diverși compuși de clorură de cobalt (III) și amoniac. După adăugarea acidului clorhidric, Werner a constatat că amoniacul nu putea fi îndepărtat complet. Apoi a propus ca amoniacul să fie mai strâns legat de ionul central cobalt.
Cu toate acestea, când s-a adăugat azotat de argint apos, unul dintre produsele formate a fost clorura de argint solidă. Cantitatea de clorură de argint formată a fost legată de numărul de molecule de amoniac legate de clorura de cobalt (III)..
De exemplu, când azotul de argint a fost adăugat la CoCl3 6NH3, cele trei cloruri au devenit clorură de argint.
Cu toate acestea, când azotul de argint a fost adăugat la CoCl3 5NH3, doar 2 din cele 3 cloruri au format clorură de argint. Când s-a tratat CoCl3.4NH3 cu azotat de argint, una dintre cele trei cloruri a precipitat sub formă de clorură de argint.
Observațiile rezultate au sugerat formarea de compuși complexi sau de coordonare. În sfera de coordonare internă, care este denumită și în unele texte drept prima sferă, liganzii sunt atașați direct de metalul central.
În sfera exterioară de coordonare, numită uneori a doua sfera, alți ioni sunt atașați la ionul complex. Werner a primit Premiul Nobel în 1913 pentru teoria coordonării (Introducere în chimia coordonării, 2017).
Această teorie a coordonării face ca metalele de tranziție să aibă două tipuri de valență: prima valență, determinată de numărul de oxidare al metalului, iar cealaltă valență numită numărul de coordonare..
Numărul de oxidare indică câte legături covalente se pot forma în metal (de exemplu, fierul (II) produce FeO) și numărul de coordonare indică câte legături de coordonare se pot forma în complex (de exemplu, fierul cu numărul de coordonare 4 produce [FeCl4]- și [FeCl4]Două-) (Compuși de coordonare, 2017).
În cazul cobaltului, acesta are un număr de coordonare 6. De aceea, în experimentele lui Werner, la adăugarea azotatului de argint, s-a obținut întotdeauna cantitatea de clorură de argint care ar lăsa un cobalt hexacoordonat..
Legăturile de coordonare ale acestui tip de compus au caracteristica de a fi colorate.
De fapt, ele sunt responsabile pentru colorarea tipică asociată unui metal (fier roșu, albastru cobalt etc.) și sunt importante pentru testele spectrofotometrice de absorbție și emisie atomică (Skodje, S.F.).
Referințe
- Atkins, P. W. (2017, 23 ianuarie). Legarea chimică. Recuperat de la britannica.com.
- Clark, J. (2012, septembrie). OBLIGARE COORDONATĂ (COVALENT DATIV). Recuperat de la chemguide.co.uk.
- Coordonează legătura covalentă. (S.F.). Recuperat de la chemistry.tutorvista.
- Compuși de coordonare. (2017, 20 aprilie). Recuperat de la chem.libretexts.org.
- Introducere în chimia coordonării. (2017, 20 aprilie). Recuperat de la chem.libretexts.org.
- Jack Halpern, G. B. (2014, 6 ianuarie). Compus de coordonare. Recuperat de la britannica.com.
- Schiller, M. (S.F.). Coordonează legătura covalentă. Recuperat de la easychem.com.
- Skodje, K. (S.F.). Legătură covalentă coordonată: definiție și exemple. Recuperat de la study.com.



Nimeni nu a comentat acest articol încă.