
Formula tiosulfat de sodiu (Na2S2O3), proprietăți și utilizări
tiosulfat de sodiu sau hiposulfit de sodiu (NaDouăSDouăSAU3) Este o sare anorganică importantă cu diverse utilizări medicale. Este, de asemenea, disponibil ca sare pentahidratată (NaDouăSDouăSAU3.5HDouăSAU).
Este un compus ionic format din doi cationi de sodiu (Na+) și anionul tiosulfat încărcat negativ (SDouăSAU3-), în care atomul central de sulf este legat de trei atomi de oxigen și un alt atom de sulf (de unde și prefixul unchiul), prin legături simple și duble cu caracter de rezonanță. Solidul există într-o structură cristalină monoclinică.
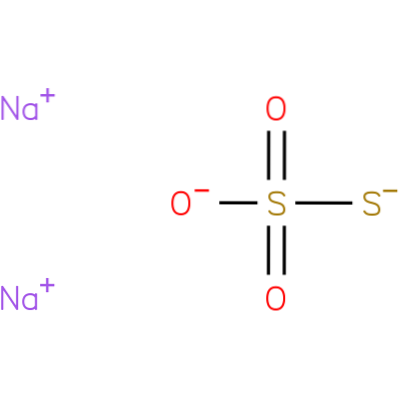
Tiosulfatul de sodiu poate fi preparat prin încălzirea sulfului cu o soluție apoasă de sulfit de sodiu sau o soluție apoasă de hidroxid de sodiu..
6NaOH + 4S → NaDouăSDouăSAU3 + 2NaDouăS + 3HDouăSAU
Este un medicament care se află pe Lista medicamentelor esențiale ale Organizației Mondiale a Sănătății, cele mai eficiente și sigure medicamente care sunt necesare într-un sistem de sănătate (Formula de tiosulfat de sodiu, S.F.).
Indice articol
- 1 Proprietăți fizice și chimice
- 2 Reactivitate și pericole
- 3 utilizări
- 3.1 Medicină
- 3.2 Iodometrie
- 3.3 Declorarea apei
- 3.4 Exploatarea aurului
- 4 Referințe
Proprietati fizice si chimice
Tiosulfatul de sodiu are o greutate moleculară de 158,11 g / mol pentru forma sa anhidră și 248,18 g / mol pentru forma pentahidratată. În plus, are o densitate de 1.667 g / ml (Centrul Național pentru Informații despre Biotehnologie., 2017).
Tiosulfatul de sodiu este cristale monoclinice incolore, fără o aromă caracteristică. Solidul menționat este eflorescent, ceea ce înseamnă că poate fi redus la praf de la sine prin pierderea apei de cristalizare atunci când este expus la aer. Aspectul său este prezentat în figura 2.

Compusul are un punct de topire de 48 ° C pentru forma pentahidrat și de la 100 ° C începe să se descompună. Apoi oDouăSDouăSAU3 Este foarte solubil în apă, fiind capabil să dizolve 70 de grame la 100 de mililitri de solvent. Compusul este practic insolubil în etanol (Royal Society of Chemistry, 2015).
Tiosulfatul de sodiu este o sare neutră care se disociază ușor în apă pentru a da ioni de sodiu și tiosulfat. N / ADouăSDouăSAU3 Este un solid stabil în condiții normale, dar se descompune la încălzire pentru a da sulfat de sodiu și polisulfură de sodiu:
4NaDouăSDouăSAU3 → 3NaDouăSW4 + N / ADouăS5
De asemenea, se descompune atunci când este tratat cu acizi diluați pentru a da sulf și dioxid de sulf (numit reacția ceasului):
N / ADouăSDouăSAU3 + 2HCl → 2NaCl + S + SODouă + HDouăSAU
Reacționează stoichiometric (în cantități echimolare) cu soluții apoase de iod, făcându-l utilizat pe scară largă în laboratoare pentru titrări pe bază de iod.
Reactivitate și pericole

Tiosulfatul de sodiu nu este un material toxic și este utilizat în scopuri medicale. Cu toate acestea, atunci când este descompus, produce vapori toxici de oxid de sulf, care pot provoca iritații la nivelul ochilor, pielii și membranelor mucoase..
Compusul poate irita ochii, pielea și căile respiratorii. Substanța este toxică pentru plămâni și mucoase. Expunerea repetată sau prelungită la substanță poate provoca deteriorarea acestor organe..
Dacă compusul intră în contact cu ochii, lentilele de contact trebuie verificate și îndepărtate. Ochii trebuie spălați imediat cu multă apă timp de cel puțin 15 minute cu apă rece.
În caz de contact cu pielea, zona afectată trebuie clătită imediat cu multă apă timp de cel puțin 15 minute, în timp ce îndepărtați îmbrăcămintea și încălțămintea contaminate. Acoperiți pielea iritată cu un emolient. Spălați hainele și încălțămintea înainte de refolosire. Dacă contactul este sever, spălați cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană.
În caz de inhalare, victima trebuie mutată într-un loc răcoros. Dacă nu respirați, se administrează respirație artificială. Dacă respirația este dificilă, dați oxigen.
Dacă compusul este ingerat, vărsăturile nu trebuie induse decât dacă sunt instruite de personalul medical. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii.
În toate cazurile, trebuie acordată asistență medicală imediată. (Fișă tehnică de securitate Tiosulfat de sodiu anhidru, 2013).
Aplicații
Medicament
Tiosulfatul de sodiu poate fi utilizat pentru a reduce unele dintre efectele secundare ale cisplatinei (un medicament pentru cancer). Este utilizat în gestionarea extravazărilor în timpul chimioterapiei. Tiosulfatul de sodiu previne alchilarea și distrugerea țesuturilor oferind un substrat pentru agenții de alchilare care au invadat țesuturile subcutanate.
De asemenea, este utilizat împreună cu un alt medicament în tratamentul de urgență al otrăvirii cu cianură (Biblioteca Națională de Medicină din S.U.A., S.F.).
În acest tratament, nitritul de sodiu este injectat intravenos pentru a produce hemoglobină care se combină cu ionul cianură, transformându-l temporar în forma cianetoglobinei. Ulterior, este injectat tiosulfatul de sodiu.
Tiosulfatul servește ca substrat pentru enzima rodanază, care catalizează conversia cianurii în tiocianatul mult mai puțin toxic, care este excretat în urină (HSDB: THIOSULFATE DE SODIU, 2003).
Tiosulfatul de sodiu este, de asemenea, utilizat ca tratament pentru calcifilaxie la persoanele care fac hemodializă cu boală renală în stadiul final. Aparent există un fenomen care nu este pe deplin înțeles, prin care acest lucru provoacă acidoză metabolică severă la unii pacienți..
Iodometrie
Tiosulfatul de sodiu reacționează stoichiometric cu iodul pentru a da iodură conform reacției:
2NaDouăSDouăSAU3 + I2 → S4SAU62− + 2I-
Această proprietate face ca compusul să fie utilizat ca titrant în determinarea iodului..
Această utilizare specială poate fi stabilită pentru a măsura conținutul de oxigen din apă printr-o serie lungă de reacții în testul Winkler pentru oxigenul dizolvat..
Este, de asemenea, utilizat în estimarea volumetrică a concentrațiilor anumitor compuși în soluție (peroxid de hidrogen, de exemplu) și în estimarea conținutului de clor din înălbitor și apă din pulbere comercială..
Declorarea apei
Tiosulfatul de sodiu este utilizat pentru declorurarea apei, inclusiv scăderea nivelului de clor pentru utilizare în acvarii, piscine și spa-uri și în stațiile de tratare a apei pentru tratarea apei de spălare stabilite înainte de eliberarea în râuri.
Reacția de reducere este similară cu reacția de reducere a iodului, tiosulfatul reduce hipocloritul (ingredient activ din înălbitor) și, prin aceasta, se oxidează la sulfat. Reacția completă este:
4NaClO + NaDouăSDouăSAU3 + 2NaOH → 4NaCl + 2NaDouăSW4 + HDouăSAU
Exploatarea aurului
Tiosulfatul de sodiu este un component utilizat ca agent alternativ de leșiere față de cianură pentru extracția aurului. Cu toate acestea, formează un complex solubil puternic cu ionii de aur (I), [Au (SDouăSAU3)Două]3-.
Avantajul acestei abordări este că tiosulfatul este în esență netoxic și că tipurile de minerale care sunt refractare la cianurarea aurului pot fi levigate de tiosulfat (M.G Aylmore, 2001).
Referințe
- EMBL-EBI. (2016, 1 iunie). tiosulfat de sodiu. Recuperat de pe ebi.ac.uk: ebi.ac.uk.
- HSDB: TIOSULFAT DE SODIU. (2003, 3 mai). Recuperat de la toxnet: toxnet.nlm.nih.gov.
- G Aylmore, D. M. (2001). Leșierea tiosulfatului de aur-A recenzie. Minerals Engineering Volumul 14, Ediția 2, 135-174. sciencedirect.com.
- Fișă tehnică de securitate Tiosulfat de sodiu anhidru. (2013, 21 mai). Recuperat de la sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie ... (2017, 18 martie). Baza de date compusă PubChem; CID = 24477. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Societatea Regală de Chimie. (2015). Tiosulfat de sodiu. Recuperat de la chemspider.com.
- Formula tiosulfatului de sodiu. (S.F.). Recuperat de la softschools: softschools.com.
- S. Biblioteca Națională de Medicină. (S.F.). Tiosulfat de sodiu (într-o venă). Recuperat de la ncbi.nlm.nih.gov.



Nimeni nu a comentat acest articol încă.