
Structura trioxidului de sulf (SO3), proprietăți, riscuri, utilizări

trioxid de sulf Este un compus anorganic format prin unirea unui atom de sulf (S) și a 3 atomi de oxigen (O). Formula sa moleculară este SO3. La temperatura camerei, SO3 este un lichid care eliberează gaze în aer.
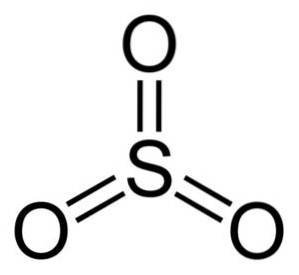
Structura sistemului de operare3 gazos este plat și simetric. Toți cei trei oxigeni sunt localizați în mod egal în jurul sulfului. SO3 Reacționează violent cu apa. Reacția este exotermă, ceea ce înseamnă că se produce căldură, cu alte cuvinte, se încălzește foarte tare.
Când SO3 lichidul se răcește, se transformă într-un solid care poate avea trei tipuri de structură: alfa, beta și gamma. Cel mai stabil este alfa, sub formă de straturi unite între ele constituind o rețea.
Trioxidul de sulf gazos este utilizat pentru prepararea acidului sulfuric fumant, numit și oleum, datorită asemănării sale cu ulei sau substanțe uleioase. O altă dintre aplicațiile sale importante este în sulfonarea compușilor organici, adică adăugarea grupărilor -SO3- acestora. Astfel, pot fi preparate substanțe chimice utile, cum ar fi detergenți, coloranți, pesticide, printre multe altele..
SO3 Este foarte periculos, poate provoca arsuri severe, leziuni ale ochilor și pielii. Nici nu trebuie inhalat sau ingerat, deoarece poate provoca moartea din cauza arsurilor interne, în gură, esofag, stomac etc..
Din aceste motive, trebuie tratat cu mare prudență. Nu ar trebui să intre niciodată în contact cu apă sau materiale combustibile precum lemn, hârtie, țesături etc., deoarece pot apărea incendii. Nici acesta nu trebuie eliminat și nici nu trebuie să intre în canalizare din cauza pericolului de explozie.
SO3 Gazele generate în procesele industriale nu ar trebui să fie eliberate în mediu, deoarece este unul dintre cei responsabili pentru ploile acide care au deteriorat deja suprafețe mari de păduri din lume.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți fizice
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punct triplu
- 3.5 Punctul de fierbere
- 3.6 Densitate
- 3.7 Presiunea vaporilor
- 3.8 Stabilitate
- 4 Proprietăți chimice
- 5 Obținerea
- 6 utilizări
- 6.1 La prepararea oleumului
- 6.2 În reacțiile chimice de sulfonare
- 6.3 La extragerea metalelor
- 6.4 În diverse utilizări
- 7 Riscuri
- 7.1 Pentru sănătate
- 7.2 Din incendiu sau explozie
- 8 Impactul asupra mediului
- 9 Referințe
Structura
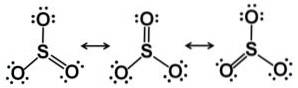
Molecula de trioxid de sulf SO3 în stare gazoasă are o structură triunghiulară plană.
Aceasta înseamnă că atât sulful, cât și cei trei oxigeni se află în același plan. Mai mult, distribuția oxigenilor și a tuturor electronilor este simetrică.
În stare solidă sunt cunoscute trei tipuri de structuri ale SO3: alfa (α-SO3), beta (β-SO3) și gamma (γ-SO3).
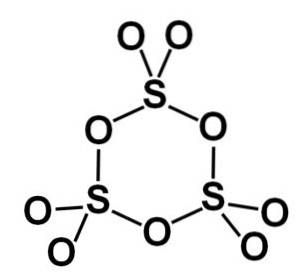
Forma gamma γ-SO3 conține trimeri ciclici, adică trei unități de SO3 formând împreună o moleculă ciclică sau în formă de inel.
Faza beta β-SO3 posedă lanțuri elicoidale infinite de tetraedru de compoziție SO4 legate între ele.
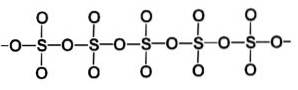
Cea mai stabilă formă este alfa α-SO3, similar cu beta, dar cu o structură stratificată, cu lanțurile unite pentru a forma o rețea.
Nomenclatură
-Trioxid de sulf
-Anhidridă sulfurică
-Oxid sulfuric
-SW3 gamma, γ-SO3
-SW3 beta, β-SO3
-SW3 alfa, α-SO3
Proprietăți fizice
Starea fizică
La temperatura camerei (în jur de 25 ° C) și presiunea atmosferică, SO3 este un lichid incolor care emite vapori în aer.
Când SO3 lichidul este pur la 25 ° C este un amestec de SO3 monomerice (moleculă unică) și trimerice (3 molecule atașate) cu formula S3SAU9, numit și SO3 gamma γ-SO3.
Pe măsură ce temperatura scade, dacă SO3 este pur când atinge 16,86 ºC, se solidifică sau îngheață la γ-SO3, numită și „SO gheață3".
Dacă conține cantități mici de umiditate (chiar urme sau cantități extrem de mici) SO-ul3 polimerizează la forma beta β-SO3 care formează cristale cu strălucire mătăsoasă.
Apoi se formează mai multe legături generând structura alfa α-SO3, care este un solid cristalin în formă de ac care seamănă cu azbestul sau azbestul.
Când alfa și beta se îmbină generează gama.
Greutate moleculară
80,07 g / mol
Punct de topire
SW3 gamma = 16,86 ºC
Punct triplu
Este temperatura la care sunt prezente cele trei stări fizice: solid, lichid și gazos. În forma alfa, punctul triplu este la 62,2 ºC, iar în beta este la 32,5 ºC.
Încălzirea formei alfa are o tendință mai mare de sublimare decât de topire. Sublimatul înseamnă a trece direct de la starea solidă la starea gazoasă, fără a trece prin starea lichidă.
Punct de fierbere
Toate formele de sistem de operare3 se fierbe la 44,8 ºC.
Densitate
SO3 lichidul (gamma) are o densitate de 1,9225 g / cm3 la 20 ° C.
SO3 gazos are o densitate de 2,76 față de aer (aer = 1), ceea ce indică faptul că este mai greu decât aerul.
Presiunea de vapori
SW3 alfa = 73 mm Hg la 25 ° C
SW3 beta = 344 mm Hg la 25 ° C
SW3 gamma = 433 mm Hg la 25 ° C
Aceasta înseamnă că forma gamma tinde să se evapore mai ușor decât beta și aceasta decât alfa..
Stabilitate
Forma alfa este cea mai stabilă structură, celelalte sunt metastabile, adică sunt mai puțin stabile.
Proprietăți chimice
SO3 reacționează energic cu apa pentru a da acid sulfuric HDouăSW4. Când reacționează, se produce multă căldură, motiv pentru care vaporii de apă sunt degajați rapid din amestec.
Fiind expus aerului SO3 absoarbe rapid umezeala, emanând vapori densi.
Este un agent de deshidratare foarte puternic, ceea ce înseamnă că elimină cu ușurință apa din alte materiale.
Sulful în SO3 are o afinitate pentru electroni liberi (adică electroni care nu sunt legați între doi atomi), astfel încât tinde să formeze complexe cu compuși care le posedă, cum ar fi piridina, trimetilamina sau dioxanul.
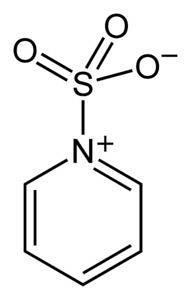
Prin formarea de complexe, sulful „împrumută” electroni de la celălalt compus pentru a umple lipsa acestuia. Trioxidul de sulf este încă disponibil în aceste complexe, care sunt utilizate în reacții chimice pentru a furniza SO3.
Este un reactiv puternic sulfonant pentru compuși organici, ceea ce înseamnă că este utilizat pentru a adăuga cu ușurință o grupare -SO3- la molecule.
Reacționează ușor cu oxizii multor metale pentru a da sulfați acestor metale.
Este coroziv pentru metale, țesuturi animale și vegetale.
SO3 Este un material dificil de manipulat din mai multe motive: (1) punctul său de fierbere este relativ scăzut, (2) are tendința de a forma polimeri solizi la temperaturi sub 30 ° C și (3) are o reactivitate ridicată față de aproape toate organele substanțe Și apa.
Poate polimeriza exploziv dacă nu conține un stabilizator și există prezență de umiditate. Sulfatul de dimetil sau oxidul de bor sunt utilizate ca stabilizatori..
Obținerea
Se obține prin reacția la 400 ° C între dioxidul de sulf SODouă și oxigen molecular ODouă. Cu toate acestea, reacția este foarte lentă și sunt necesari catalizatori pentru a crește viteza reacției..
2 ASADouă + SAUDouă ⇔ 2 SO3
Printre compușii care accelerează această reacție se numără Pt metalul platinei, pentoxidul de vanadiu VDouăSAU5, oxid feric FeDouăSAU3 și oxid nitric NO.
Aplicații
În prepararea oleumului
Una dintre principalele sale aplicații este prepararea oleumului sau a acidului sulfuric fumant, așa-numitul deoarece emite vapori vizibili cu ochiul liber. Pentru a-l obține, SO este absorbit3 în acid sulfuric concentrat HDouăSW4.

Acest lucru se face în turnuri speciale din oțel inoxidabil, unde acidul sulfuric concentrat (care este lichid) coboară și SO3 sifonul crește.
Lichidul și gazul vin în contact și se reunesc, formând oleum, care este un lichid cu aspect uleios. Acesta posedă un amestec de HDouăSW4 Așadar3, dar are și molecule de acid disulfuric HDouăSDouăSAU7 și H trisulfuricDouăS3SAU10.
În reacțiile chimice de sulfonare
Sulfonarea este un proces cheie în aplicații industriale la scară largă pentru fabricarea detergenților, surfactanților, coloranților, pesticidelor și produselor farmaceutice..
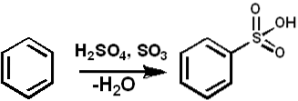
SO3 servește ca agent de sulfonare pentru a prepara uleiuri sulfonate și detergenți alchil-aril-sulfonați, printre mulți alți compuși. Următorul arată reacția de sulfonare a unui compus aromatic:
ArH + SO3 → ArSO3H
Oleum sau SO pot fi utilizate pentru reacții de sulfonare.3 sub forma complexelor sale cu piridină sau cu trimetilamină, printre altele.
În extragerea metalelor
SO gaz3 A fost folosit în tratamentul mineralelor. Oxizii simpli ai metalelor pot deveni sulfați mult mai solubili prin tratarea lor cu SO3 la temperaturi relativ scăzute.
Mineralele sulfuroase precum pirita (sulfura de fier), calcozina (sulfura de cupru) și millerita (sulfura de nichel) sunt cele mai economice surse de metale neferoase, deci tratarea cu SO3 permite obținerea acestor metale cu ușurință și la un cost redus.
Sulfurile de fier, nichel și cupru reacționează cu gazul SO3 chiar la temperatura camerei, formând sulfații respectivi, care sunt foarte solubili și pot fi supuși altor procese pentru a obține metalul pur.
În diverse utilizări
SO3 folosit la prepararea acidului clorosulfuric numit și acid clorosulfonic HSO3Cl.
Trioxidul de sulf este un oxidant foarte puternic și este utilizat la fabricarea explozivilor..
Riscuri
Pentru sănătate
SO3 Este un compus foarte toxic pe toate căile, adică prin inhalare, ingestie și contact cu pielea.
Iritant și corodând membranele mucoase. Provoacă arsuri ale pielii și ale ochilor. Vaporii săi sunt foarte toxici la inhalare. Apar arsuri interne, dificultăți de respirație, dureri în piept și edem pulmonar.

Este otrăvitor. Ingerarea sa generează arsuri severe ale gurii, esofagului și stomacului. În plus, se suspectează că este cancerigen.
Din incendiu sau explozie
Reprezintă un pericol de incendiu la contactul cu materiale de origine organică precum lemnul, fibrele, hârtia, uleiul, bumbacul, printre altele, mai ales dacă sunt umede..
Există, de asemenea, un risc dacă intrați în contact cu baze sau agenți reducători. Se combină cu apă exploziv, formând acid sulfuric.
Contactul cu metalele poate produce hidrogen gazos HDouă care este foarte inflamabil.
Încălzirea în borcane de sticlă trebuie evitată pentru a preveni posibila rupere violentă a recipientului..
Impact asupra mediului
SO3 Este considerat unul dintre principalii poluanți prezenți în atmosfera terestră. Acest lucru se datorează rolului său în formarea aerosolilor și contribuției sale la ploile acide (datorită formării acidului sulfuric HDouăSW4).

SO3 se formează în atmosferă prin oxidarea dioxidului de sulf SODouă. La formarea SO-ului3 reacționează rapid cu apa pentru a forma acid sulfuric HDouăSW4. Conform studiilor recente, există și alte mecanisme de transformare a SO3 în atmosferă, dar datorită cantității mari de apă prezentă în ea, este considerat încă mult mai probabil ca SO3 devine în primul rând HDouăSW4.
SO3 Deșeurile industriale gazoase sau gazoase care le conțin nu trebuie aruncate în atmosferă, deoarece sunt un poluant periculos. Este un gaz foarte reactiv și, așa cum s-a spus deja, în prezența umidității în aer, SO3 devine acid sulfuric HDouăSW4. Prin urmare, în aer SO3 persistă sub formă de acid sulfuric formând picături mici sau aerosoli.
Dacă picăturile de acid sulfuric pătrund în căile respiratorii ale oamenilor sau animalelor, acestea cresc rapid ca dimensiune datorită umezelii prezente acolo, deci au șansa de a pătrunde în plămâni. Unul dintre mecanismele prin care ceața acidă a lui HDouăSW4 (adică SO3) poate produce o toxicitate puternică datorită faptului că modifică pH-ul extracelular și intracelular al organismelor vii (plante, animale și oameni).
Potrivit unor cercetători, ceața din SO3 Este cauza creșterii astmaticilor într-o zonă din Japonia. ASA ceata3 Are un efect foarte coroziv asupra metalelor, astfel încât structurile metalice construite de oameni, cum ar fi unele poduri și clădiri, pot fi grav afectate..
SO3 Lichidul nu trebuie aruncat în canalele de canalizare sau canalizare. Dacă este vărsat în canalizare, poate crea un pericol de incendiu sau explozie. Dacă este vărsat accidental, nu direcționați un curent de apă către produs. Nu trebuie niciodată absorbit în rumeguș sau în alt absorbant combustibil, deoarece poate provoca incendii.
Acesta trebuie absorbit în nisip uscat, pământ uscat sau alt absorbant inert total uscat. SO3 Nu trebuie eliberat în mediul înconjurător și nu trebuie permis niciodată să intre în contact cu acesta. Ar trebui ținut departe de sursele de apă, deoarece cu aceasta produce acid sulfuric dăunător organismelor acvatice și terestre..
Referințe
- Sarkar, S. și colab. (2019). Influența amoniacului și a apei asupra destinului trioxidului de sulf în troposferă: investigație teoretică a căilor de formare a acidului sulfamic și a acidului sulfuric. J Phys Chem A. 2019; 123 (14): 3131-3141. Recuperat de la ncbi.nlm.nih.gov.
- Muller, T.L. (2006). Acid sulfuric și trioxid de sulf. Kirk-Othmer Encyclopedia of Chemical Technology. Volumul 23. Recuperat de pe onlinelibrary.wiley.com.
- S.U.A. Biblioteca Națională de Medicină. (2019). Trioxid de sulf. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Kikuchi, R. (2001). Managementul de mediu al emisiilor de trioxid de sulf: impactul SO3 asupra sănătății umane. Managementul mediului (2001) 27: 837. Recuperat de pe link.springer.com.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Ismail, M.I. (1979). Extracția metalelor din sulfuri folosind trioxid de sulf în pat fluidizat. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Recuperat de la onlinelibrary.wiley.com.



Nimeni nu a comentat acest articol încă.