
Voltametrie din ce constă, tipuri și aplicații
voltametrie Este o tehnică electroanalitică care determină informația unei specii chimice sau a unui analit din curenții electrici generați de variația unui potențial aplicat. Adică potențialul aplicat E (V) și timpul (t) sunt variabile independente; în timp ce curentul (A), variabila dependentă.
Specia chimică trebuie să fie în mod obișnuit electroactivă. Ce înseamnă? Înseamnă că trebuie să piardă (să se oxideze) sau să câștige (să reducă) electronii. Pentru ca reacția să înceapă, electrodul de lucru trebuie să furnizeze potențialul necesar determinat teoretic de ecuația Nernst.
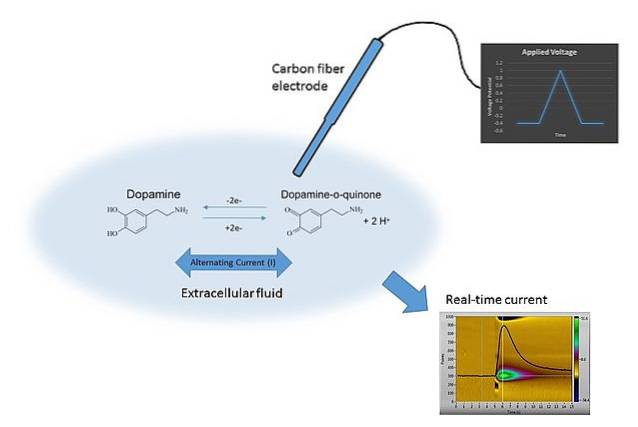
Un exemplu de voltametrie poate fi văzut în imaginea de mai sus. Electrodul din imagine este realizat din fibre de carbon, care este scufundat în mediul de dizolvare. Dopamina nu se oxidează, formând două grupări carbonil C = O (partea dreaptă a ecuației chimice) dacă nu se aplică potențialul adecvat.
Acest lucru se realizează prin scanarea E cu valori diferite, limitate de mulți factori, cum ar fi soluția, ionii prezenți, același electrod și dopamină..
Prin variația E în timp, se obțin două grafice: primul E v t (triunghiul albastru) și al doilea, răspunsul C vs t (galben). Formele sale sunt caracteristice pentru determinarea dopaminei în condițiile experimentului..
Indice articol
- 1 Ce este voltametria??
- 1.1 Unda voltametrica
- 1.2 Instrumentație
- 2 tipuri
- 2.1 Voltametria impulsurilor
- 2.2 Voltametrie de redizolvare
- 3 Aplicații
- 4 Referințe
Ce este voltametria?
Voltametria a fost dezvoltată datorită invenției tehnicii polarografiei de către laureatul Premiului Nobel pentru chimie din 1922, Jaroslav Heyrovsky. În el, electrodul picăturii de mercur (EGM) este în mod constant reînnoit și polarizat.
Deficiențele analitice ale acestei metode în acel moment au fost rezolvate cu utilizarea și proiectarea altor microelectrozi. Acestea variază enorm în ceea ce privește materialul, de la carbon, metale nobile, diamante și polimeri, până la designul lor, discuri, cilindri, foi; și, de asemenea, în modul în care interacționează cu soluția: staționare sau rotative.
Toate aceste detalii sunt menite să favorizeze polarizarea electrodului, care provoacă o descompunere a curentului înregistrat cunoscut sub numele de curent limită (i1). Aceasta este proporțională cu concentrația analitului și jumătate din potența E (E1/2) pentru a ajunge la jumătate din curentul menționat (i1/2) este caracteristic speciei.
Apoi, determinarea valorilor lui E1/2 pe curba unde curentul obținut cu variația lui E, numit voltamperogramă, se poate identifica prezența unui analit. Adică, fiecare analit, având în vedere condițiile experimentului, va avea propria sa valoare E1/2.
Unda voltametrică
În voltametrie lucrezi cu multe grafice. Prima dintre ele este curba E vs t, care permite urmărirea diferențelor de potențial aplicate în funcție de timp.
Dar, în același timp, circuitul electric înregistrează valorile C produse de analit prin pierderea sau câștigarea de electroni în vecinătatea electrodului..
Deoarece electrodul este polarizat, mai puțin analit poate difuza din interiorul soluției în el. De exemplu, dacă electrodul este încărcat pozitiv, specia X- va fi atras de el și va merge spre el prin simpla atracție electrostatică.
Dar X- Nu ești singur: există alți ioni prezenți în mediul tău. Unii cationi M+ pot intra în calea electrodului prin încadrarea acestuia în „grupuri” de sarcini pozitive; și la fel, N anioni- poate fi prins în jurul electrodului și poate preveni X- Am ajuns la el.
Suma acestor fenomene fizice determină pierderea curentului și acest lucru este observat în curba C vs E și forma sa similară cu cea a unui S, numită formă sigmoidă. Această curbă este cunoscută sub numele de undă voltammetrică..
Instrumentaţie
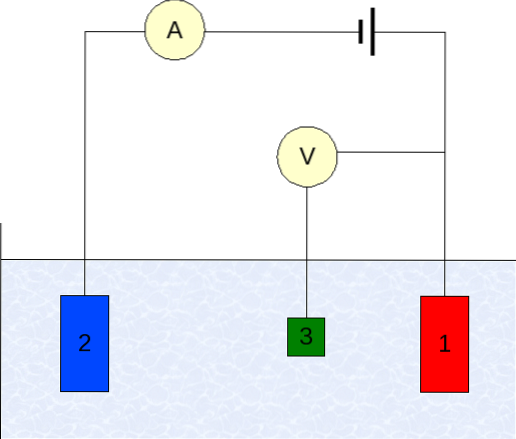
Instrumentarea voltametriei variază în funcție de analit, solvent, tipul de electrod și aplicație. Dar, marea majoritate a acestora se bazează pe un sistem format din trei electrozi: unul pentru lucru (1), auxiliar (2) și cel de referință (3)..
Principalul electrod de referință utilizat este electrodul de calomel (ECS). Acest lucru, împreună cu electrodul de lucru, face posibilă stabilirea unei diferențe de potențial ΔE, deoarece potențialul electrodului de referință rămâne constant în timpul măsurătorilor..
Pe de altă parte, electrodul auxiliar este însărcinat cu controlul sarcinii care trece la electrodul de lucru, pentru a-l menține în valori E acceptabile. Variabila independentă, diferența de potențial aplicată, este cea obținută prin adăugarea potențialelor electrozilor de lucru și de referință..
Tipuri

Imaginea de mai sus prezintă un grafic E vs t, denumit și undă potențială pentru o voltametrie de baleiaj liniar..
Se poate observa că pe măsură ce timpul trece, potențialul crește. La rândul său, această baleiaj generează o curbă de răspuns sau voltamperogramă C vs E a cărei formă va fi sigmoidă. Va veni un punct în care, indiferent de cât crește E, nu va exista o creștere a curentului.
Alte tipuri de voltametrie pot fi deduse din acest grafic. Cum? Modificarea undei potențiale E vs t prin impulsuri potențiale bruște urmând anumite tipare. Fiecare tipar este asociat cu un tip de voltametrie și cuprinde propria sa teorie și condițiile experimentale..
Voltametria pulsului
În acest tip de voltametrie, amestecuri de doi sau mai mulți analiți ale căror valori E pot fi analizate1/2 sunt foarte aproape unul de altul. Astfel, un analit cu E1/2 de 0,04V poate fi identificat în compania altuia cu un E1/2 de 0,05V. În timp ce este în voltametrie liniară, diferența trebuie să fie mai mare de 0,2 V..
Prin urmare, există sensibilitate mai mare și limite mai mici de detecție; adică analiții pot fi determinați la concentrații foarte scăzute.
Valurile potențialelor pot avea modele similare cu scările, scările înclinate și triunghiurile. Acesta din urmă corespunde voltametriei ciclice (CV pentru acronimul său în engleză, prima imagine).
În CV se aplică un potențial E într-o singură direcție, pozitiv sau negativ, și apoi, la o anumită valoare a lui E la momentul t, același potențial este aplicat din nou, dar în direcția opusă. La studierea voltamperogramelor generate, valorile maxime relevă prezența intermediarilor într-o reacție chimică.
Voltametrie de redizolvare
Aceasta poate fi de tip anodic sau catodic. Constă din electrodepunerea analitului pe un electrod de mercur. Dacă analitul este un ion metalic (cum ar fi CdDouă+), se va forma un amalgam; și dacă este un anion, (cum ar fi MoO4Două-) o sare de mercur insolubilă.
Apoi, se aplică impulsuri de potențial pentru a determina concentrația și identitatea speciei electrodepozitate. Astfel, amalgamul este redizolvat, ca sărurile de mercur.
Aplicații
-Voltametria de redizolvare anodică este utilizată pentru a determina concentrația metalelor dizolvate în fluid.
-Permite studierea cineticii proceselor de redox sau adsorbție, mai ales atunci când electrozii sunt modificați pentru a detecta un anumit analit.
-Baza sa teoretică a fost utilizată pentru fabricarea biosenzorilor. Cu acestea, se poate determina prezența și concentrația moleculelor biologice, proteinelor, grăsimilor, zaharurilor etc..
-În cele din urmă, detectează participarea intermediarilor la mecanismele de reacție.
Referințe
- González M. (22 noiembrie 2010). Voltametrie. Recuperat de pe: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E. și Vivó, M ... (2002). Analiza electrochimică. Jurnalul de diagnostic biologic, 51 (1), 18-27. Recuperat de la scielo.isciii.es
- Chimie și Știință. (18 iulie 2011). Voltametrie. Recuperat de la: laquimicaylaciencia.blogspot.com
- Quiroga A. (16 februarie 2017). Voltametrie ciclică. Recuperat de pe: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Tehnici voltametrice. [PDF]. Universitatea Tufts. Recuperat din: brown.edu
- Ziua R. și Underwood A. Chimie analitică cantitativă (ediția a cincea). PEARSON Prentice Hall.


Nimeni nu a comentat acest articol încă.