
Pentru ce este Tabelul periodic? 7 Utilizări importante

tabelul periodic Servește pentru a arăta relațiile dintre diferitele elemente; Poate fi, de asemenea, utilizat pentru a prezice proprietățile elementelor noi încă descoperite sau care nu au fost încă sintetizate..
Oferă informații și date despre grupuri, elemente, masă atomică, energie de ionizare, configurație electronică, număr atomic, electronegativitate și stări de oxidare. Tabelul periodic oferă, de asemenea, un cadru util pentru analiza comportamentului chimic; Este utilizat pe scară largă în domeniul chimiei și în multe alte științe.
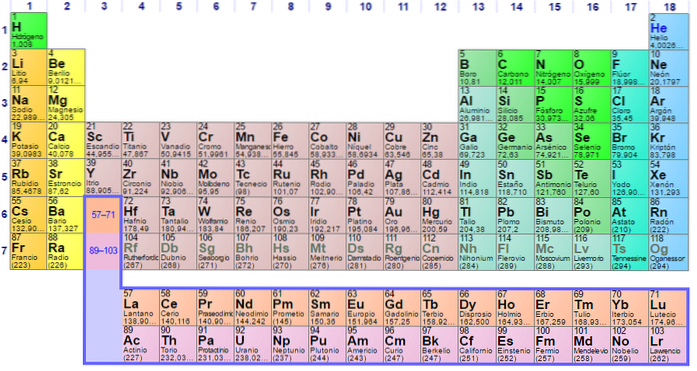
A fost construit în 1869 de către omul de știință rus Dmitri Ivanovici Mendeleev pentru a vizualiza diferitele relații dintre diferitele elemente chimice..
Tabelul periodic este ordonat după numărul său atomic, configurațiile electronice și proprietățile chimice recurente. De asemenea, este ordonat astfel încât elementele cu comportamente similare să fie în aceeași coloană.
Tabelul are patru blocuri dreptunghiulare cu proprietăți chimice similare. În general, elementele situate pe partea stângă a unui rând sunt metale, iar nemetalele sunt situate pe dreapta.
Elementele sunt situate pe tabelul periodic pe baza structurii lor atomice. Fiecare rând și fiecare coloană au caracteristici speciale.
Toate rândurile din tabel sunt citite de la stânga la dreapta și fiecare rând este denumit punct. Fiecare coloană din tabel se numește grup. Fiecare grup din tabel are același număr de electroni.
Este ușor să găsiți numărul de electroni din învelișul exterior al fiecărui element din tabel. Grupul unu are un electron, grupul doi are doi și așa mai departe.
Un bun tabel periodic este un instrument excelent pentru rezolvarea problemelor în chimie. Tabelele periodice pot fi găsite pe web sau pot fi tipărite.
Utilizările tabelului periodic la ce servește?
Cunoașteți simbolul elementului chimic
Simbolurile sunt prescurtate pentru numele articolului. În multe cazuri, abrevierea provine de la numele latin original.
Fiecare simbol are una sau două litere ca prescurtare. De obicei, simbolul este o abreviere a numelui elementului, dar unele simboluri se referă la numele vechi ale elementelor.
Un exemplu al acestui caz este argintul; simbolul său este Ag, care se referă la vechiul său nume care a fost argentum.
Cunoașteți numărul atomic al elementului
Acesta este numărul de protoni pe care îl conține un atom al acestui element. Numărul de protoni este factorul decisiv atunci când vine vorba de a distinge un element de altul. Variația numărului de electroni sau neutroni nu modifică tipul de element.
Schimbarea numărului de electroni produce ioni, în timp ce modificările numărului de neutroni produc izotopi. Tabelul periodic modern este aranjat în ordine crescătoare a numărului atomic.
Identificați ce înseamnă perioadele și grupurile din tabelul periodic
Rândurile orizontale se numesc puncte. Fiecare perioadă indică cel mai înalt nivel de energie pe care îl ocupă fiecare dintre electronii acelui element în starea sa de bază..
Coloanele verticale se numesc grupuri. Fiecare element dintr-un grup are același număr de electroni de valență și se comportă de obicei într-un mod similar atunci când este legat de alte elemente..
Ultimele două rânduri, lantanidele și actinidele, aparțin grupei 3B și sunt listate separat..
Cunoașteți numele elementului
Multe tabele periodice includ, de asemenea, numele complet al articolului. Acest lucru este util atunci când vine vorba de cunoașterea unui element, deoarece nu vă puteți aminti întotdeauna simbolurile tuturor elementelor.
Familiarizați-vă cu masa atomică a elementului în unități de masă atomică
Acest număr se referă la masa grea medie a izotopilor unui element chimic. Tabelul periodic original al lui Mendeleev a fost organizat astfel încât elementele să fie afișate în ordine crescătoare de masă atomică sau greutate..
Identificați tipurile de elemente
Multe tabele periodice identifică diferite tipuri de elemente folosind culori diferite pentru diferite tipuri de elemente.
Aceste tipuri includ metale alcaline, metale de bază, metale de tranziție, nemetale, gaze nobile, alogeni, pământuri alcaline, semi-metale, actinide și lantanide..
Afișați diferitele tendințe (periodicitate)
Tabelul periodic este organizat pentru a arăta diferitele tipuri de tendințe (periodicitate). Între ele:
- Raza atomică, care este jumătate din distanța dintre centrele a doi atomi care abia se ating unul de celălalt:
- Crește pe măsură ce vă deplasați de sus în jos în tabelul periodic.
- Coboară pe măsură ce se deplasează de la stânga la dreapta prin tabelul periodic.
- Energia de ionizare, care este energia necesară pentru a elimina un electron din atom.
- Coboară pe măsură ce se deplasează în sus și în jos în tabelul periodic.
- Crește pe măsură ce vă deplasați de la stânga la dreapta pe tabelul periodic.
- Electronegativitatea, care măsoară capacitatea de a forma o legătură chimică.
- Coboară pe măsură ce se mișcă în sus și în jos.
- Crește pe măsură ce vă deplasați de la stânga la dreapta.
- Afinitate electronică, care se referă la capacitatea elementului de a accepta un electron.
Afinitatea electronică poate fi prezisă pe baza grupurilor de elemente. Gazele nobile, cum ar fi argonul și neonul, au o afinitate electronică aproape zero și tind să nu accepte electroni..
Halogenii, precum clorul și iodul, au afinități electronice ridicate. Majoritatea celorlalte grupuri de elemente au afinități electronice mai mici decât ale alogenilor, dar mult mai mari decât cele ale gazelor nobile..
Referințe
- Care este scopul tabelului periodic? Recuperat de la reference.com
- Cum se utilizează un tabel periodic (2017) Recuperat de la thoughtco.com
- Cum sunt organizate elementele tabelului periodic? Recuperat de la reference.com
- Tabelul periodic. Recuperat de pe wikipeda.org
- De ce este util tabelul periodic. Recuperat de la reference.com


Nimeni nu a comentat acest articol încă.