
Structura acidului disulfuric, proprietăți, nomenclatură și utilizări
acid disulfuric este unul dintre numeroșii oxoacizi de sulf, a căror formulă chimică este HDouăSDouăSAU7. Formula afirmă în mod explicit că există doi atomi de sulf și, după cum indică și numele său, trebuie să existe două molecule de HDouăSW4 unul singur; cu toate acestea, există șapte oxigeni în loc de opt, deci un sulf trebuie să aibă trei.
Acest acid este considerat unul dintre principalii componenți ai oleumului (sau fumurii acidului sulfuric), care este o formă „densă” a acidului sulfuric. Aceasta este predominanța sa, încât unii consideră oleum ca un sinonim al acidului disulfuric; care este cunoscut și sub denumirea tradițională de acid pirosulfuric.

Imaginea prezintă un recipient cu oleum, cu o concentrație de trioxid de sulf, SO3, la 20%. Această substanță se caracterizează prin faptul că este uleioasă și incoloră; deși poate deveni gălbuie sau maro în funcție de concentrația de SO3 și prezența unor impurități.
Cele de mai sus se referă la participarea SO3 în HDouăSDouăSAU7; adică o moleculă de HDouăSW4 reacționează cu un SO3 pentru a forma acid disulfuric. Acesta fiind cazul atunci, HDouăSDouăSAU7 poate fi scris și ca HDouăSW4· SW3.
Indice articol
- 1 Structura acidului disulfuric
- 2 Proprietăți
- 2.1 Reacția de deshidratare a zahărului
- 3 Nomenclatură
- 4 utilizări
- 4.1 Depozitează acid sulfuric
- 4.2 Sinteza acidului sulfuric 100%
- 4.3 Sulfonare
- 5 Referințe
Structura acidului disulfuric
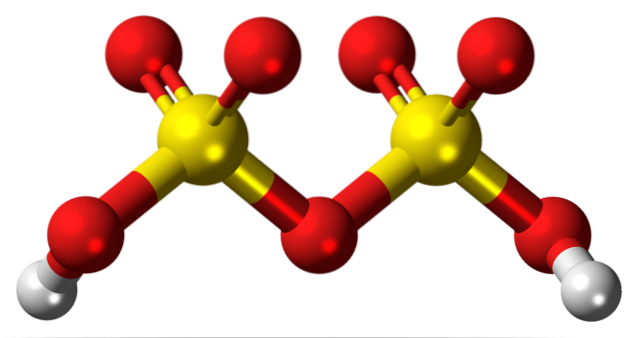
Deasupra este structura lui HDouăSDouăSAU7 într-un model de sfere și bare. Observați la prima vedere simetria moleculei: partea stângă a podului de oxigen este identică cu cea dreaptă. Din această perspectivă, structura poate fi descrisă cu formula HO3ASA SI ASA3H.
La ambele capete sunt fiecare grupare hidroxil, al cărei hidrogen, prin efectul inductiv al tuturor acestor atomi de oxigen, își mărește sarcina parțială pozitivă; și, în consecință, acidul disulfuric are o aciditate chiar mai puternică decât acidul sulfuric.
Molecula poate fi scrisă ca HDouăSW4· SW3. Cu toate acestea, aceasta se referă mai mult la o compoziție de oleum decât la structura unei molecule..
Cu toate acestea, dacă la H se adaugă o moleculă de apăDouăSDouăSAU7, se vor elibera două molecule de HDouăSW4:
HDouăSDouăSAU7 + HDouăSAU <=> 2HDouăSW4
Echilibrul se poate deplasa la stânga: la formarea lui HDouăSDouăSAU7 din HDouăSW4 dacă i se furnizează căldură. Din acest motiv, la HDouăSDouăSAU7 este, de asemenea, cunoscut sub numele de acid pirosulfuric; deoarece poate fi generat după încălzirea acidului sulfuric.
De asemenea, după cum sa menționat la început, HDouăSDouăSAU7 este format din combinația directă a lui HDouăSW4 Așadar3:
SW3 + HDouăSW4 <=> HDouăSDouăSAU7
Proprietăți
Proprietățile acidului disulfuric nu sunt foarte bine definite, deoarece este extrem de dificil să se izoleze pur de oleum.
Trebuie amintit că în oleum pot exista și alți compuși, cu formulele HDouăSW4XSO3, unde în funcție de valoarea lui x poți avea chiar și structuri polimerice.
O modalitate de a o vizualiza este să ne imaginăm că structura superioară a lui HDouăSDouăSAU7 devine mai alungit de mai multe unități de SO3 și poduri de oxigen.
Într-o stare aproape pură, aceasta constă dintr-un solid cristalin instabil (fumigant) care se topește la 36 ° C. Cu toate acestea, acest punct de topire poate varia în funcție de compoziția reală..
Acidul disulfuric poate forma ceea ce este cunoscut sub numele de săruri disulfat (sau pirosulfat). De exemplu, dacă reacționează cu hidroxid de potasiu, formează pirosulfat de potasiu, KDouăSDouăSAU7.
În plus, se poate comenta că are o greutate moleculară de 178 g / mol și doi echivalenți de acid (ioni 2 H+ care poate fi neutralizat cu o bază puternică).
Reacția de deshidratare a zahărului
Cu acest compus sub formă de oleum, se poate efectua o reacție curioasă: transformarea cuburilor de zahăr în blocuri de carbon.
HDouăSDouăSAU7 reacționează cu zaharurile eliminând toate grupările lor OH sub formă de apă, ceea ce favorizează noi legături între atomii de carbon; articulații care ajung să provoace carbon negru.
Nomenclatură
Acidul sulfuric este considerat anhidrida acidului sulfuric; adică pierde o moleculă de apă ca urmare a condensării dintre două molecule de acid. Având în vedere atât de multe nume posibile pentru acest compus, nomenclatura IUPAC recomandă pur și simplu acidul disulfuric..
Termenul „piro” se referă exclusiv la cel format ca produs al aplicării căldurii. IUPAC nu recomandă acest nume pentru HDouăSDouăSAU7; dar este folosit și astăzi de mulți chimiști.
Finalul -ico rămâne neschimbat, deoarece atomul de sulf continuă să mențină o valență de +6. De exemplu, poate fi calculat folosind următoarea operație aritmetică:
2H + 2S + 7O = 0
2 (+1) + 2S + 7 (-2) = 0
S = 6
Aplicații
Depozitează acid sulfuric
Acidul disulfuric, dată fiind proprietatea sa de a se solidifica ca oleum, este capabil să dizolve și să stocheze acidul sulfuric mai sigur. Acest lucru se datorează faptului că sistemul de operare3 scapă creând o „ceață” irespirabilă, care este mult mai solubilă în HDouăSW4 decât în apă. Pentru a obține HDouăSW4, ar fi suficient să adăugați apă la oleum:
HDouăSDouăSAU7 + HDouăSAU <=> 2HDouăSW4
Sinteza de acid sulfuric 100%
Din ecuația de mai sus, HDouăSW4 se diluează în apa adăugată. De exemplu, dacă aveți o soluție apoasă de HDouăSW4, unde SO3 Tinde să scape și reprezintă un risc pentru lucrători. Când se adaugă oleum la soluție, acesta reacționează cu apa, formând mai mult acid sulfuric. adică creșterea concentrației.
Dacă rămâne puțină apă, se adaugă mai mult SO3, care reacționează cu HDouăSW4 pentru a produce mai mult acid disulfuric sau oleum, iar apoi acesta este rehidratat prin „uscarea” HDouăSW4. Procesul se repetă de suficiente ori pentru a obține acid sulfuric la o concentrație de 100%.
Un proces similar este utilizat pentru a obține acid azotic 100%. De asemenea, a fost folosit pentru deshidratarea altor substanțe chimice, utilizate pentru fabricarea explozivilor..
Sulfonare
Este folosit pentru a sulfonate structuri, cum ar fi cele ale coloranților; adică adăugați grupuri -SO3H, care prin pierderea protonului său acid se poate ancora pe polimerul fibrei textile.
Pe de altă parte, aciditatea oleum este utilizată pentru a obține a doua nitrare (adăugați grupări -NODouă) la inele aromatice.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (a patra editie). Mc Graw Hill.
- Wikipedia. (2018). Acid disulfuric. Recuperat de pe: en.wikipedia.org
- PubChem. (2019). Acid pirosulfuric. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Seong Kyu Kim, Han Myoung Lee și Kwang S. Kim. (2015). Acid disulfuric disociat de două molecule de apă: ab initio și calcule ale teoriei funcționale a densității. Phys. Chem. Chem. Phys., 2015, 17, 28556
- Servicii de sănătate Contra Costa. (s.f.). Oleum / trioxid de sulf: fișă tehnică chimică. [PDF]. Recuperat de pe: cchealth.org



Nimeni nu a comentat acest articol încă.