
Structura oxidului de bariu (BaO), proprietăți, utilizări, riscuri

oxid de bariu Este un solid anorganic format dintr-un atom de bariu (Ba) și un atom de oxigen (O). Formula sa chimică este BaO. Este un solid cristalin alb și este higroscopic, adică absoarbe umezeala din aer, dar atunci când face acest lucru reacționează cu el..
Reacția rapidă a oxidului de bariu cu apa îl face să fie folosit în laboratoarele de analize chimice pentru a se usca, adică pentru a elimina apa din solvenții organici, care sunt compuși lichizi care servesc la dizolvarea altor substanțe..

BaO se comportă ca o bază puternică, prin urmare reacționează cu multe tipuri de acizi. De exemplu, reacționează ușor cu dioxidul de carbon CODouă din aer pentru a forma carbonat de bariu BaCO3.
Este utilizat la fabricarea polimerilor pentru cabluri de alimentare și ca ingredient pentru rășini pentru etanșarea găurilor dinților care au fost vindecați.
Oxidul de bariu (BaO) este utilizat și în industria ceramică, atât pentru acoperirea acestuia cu glazură, cât și pentru fabricarea acestuia. De asemenea, este utilizat în amestecuri de ciment pentru a crește rezistența la compresiune a produsului final..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți fizice
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Solubilitate
- 4 Proprietăți chimice
- 5 Riscuri
- 6 Obținerea
- 7 utilizări
- 7.1 Ca desicant pentru solvenți organici
- 7.2 În lămpile cu descărcare
- 7.3 La fabricarea ceramicii
- 7.4 La prepararea amestecurilor de ciment
- 7.5 În diverse aplicații
- 8 Referințe
Structura
Oxidul de bariu BaO este alcătuit dintr-un cation BaDouă+ și un anion oxigen ODouă-.
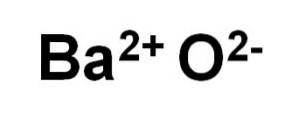
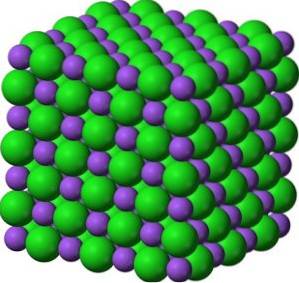
În cristalele sale, BaO formează rețele ionice cubice (în formă de cub) de tip clorură de sodiu.
Configurația electronică a ionului de bariu este: [Xe] 6s0 deoarece a pierdut cei doi electroni ai carcasei 6s. Această configurație este foarte stabilă.
Nomenclatură
-Oxid de bariu
-Monoxid de bariu
Proprietăți fizice
Starea fizică
Solid cristalin alb-gălbui.
Greutate moleculară
153,33 g / mol
Punct de topire
1923 ºC
Punct de fierbere
Aproximativ 2000 ºC.
Densitate
5,72 g / cm3
Solubilitate
Ușor solubil în apă: 3,8 g / 100 ml la 20 ° C.
Proprietăți chimice
Oxidul de bariu BaO reacționează rapid cu apa, degajând căldură și formând o soluție corozivă de hidroxid de bariu Ba (OH)Două, care este cel mai solubil hidroxid dintre hidroxizii alcalino-pământoși.
BaO + HDouăO → Ba (OH)Două
BaO este o bază puternică. Reacționează exoterm (adică cu evoluția căldurii) cu toate tipurile de acizi.
Cu CODouă BaO reacționează pentru a forma carbonat de bariu BaCO3.
BaO + CODouă → BaCO3
BaO este higroscopic, deci, dacă este lăsat expus mediului, se unește încetul cu încetul cu umiditatea aerului, formând Ba (OH)Două care se combină cu dioxidul de carbon CODouă din aer pentru a da carbonat de bariu BaCO3.
Când monoxidul de bariu BaO este încălzit în prezența aerului, acesta se combină cu oxigenul pentru a forma peroxid de bariu BaODouă. Reacția este reversibilă.
2 BaO + ODouă ⇔ 2 BaODouă
În prezența apei, poate reacționa cu aluminiu Al sau zincul Zn, formând oxizii sau hidroxizii metalelor menționate și generând hidrogen gazos HDouă.
Poate iniția polimerizarea compușilor organici polimerizabili, cum ar fi epoxizii.
Riscuri
Poate fi toxic dacă este înghițit. Nu trebuie să intre în contact cu pielea. Este iritant pentru ochi, piele și căile respiratorii. Poate fi dăunător sistemului nervos. Este capabil să provoace niveluri scăzute de potasiu, ducând la tulburări cardiace și musculare.
Obținerea
Oxidul de bariu BaO poate fi obținut prin încălzirea carbonatului de bariu BaCO3 cu cărbune. Se formează BaO și se eliberează CO monoxid de carbon.
Bacchus3 + C → BaO + 2 CO ↑
Aplicații
Ca desicant pentru solvenți organici
Datorită ușurinței sale de a reacționa cu apa, BaO a fost utilizat de la mijlocul secolului trecut ca desicant pentru benzină și solvenți organici bazici sau neutri..
BaO se usucă foarte activ în jurul său, preia umezeala foarte repede, cu o evoluție destul de mică de căldură, formând hidroxid de bariu Ba (OH)Două care este stabilă până la aproximativ 1000 ºC. Din acest motiv, BaO poate fi utilizat la temperaturi ridicate..
De asemenea, are o capacitate mare de absorbție a apei. Pentru fiecare moleculă de BaO, una din apă și Ba (OH) pot fi absorbiteDouă rezultatul poate absorbi și o anumită cantitate de apă.
Este potrivit pentru laboratoarele de chimie analitică. Nu lipicios.
Poate fi utilizat în desicatoare, care sunt recipiente mari din sticlă cu capac în care mediul intern este păstrat uscat. BaO menține atmosfera în miniatură a desicatorului uscată.

Acești desicatori sunt utilizați pentru plasarea substanțelor sau reactivilor și astfel împiedică absorbția apei din mediu.
De asemenea, este utilizat pentru uscarea gazelor de bază, cum ar fi amoniacul NH.3.
În lămpile cu descărcare
BaO este plasat pe electrozii lămpilor cu descărcare ca material care emite electroni.
Lămpile de descărcare sunt fabricate dintr-un tub de sticlă, cuarț sau alt material adecvat, conțin un gaz inert și, în majoritatea cazurilor, un vapor de metal. Vaporii metalici pot fi sodiu sau mercur.

Descărcările electrice apar în interiorul tubului, deoarece acesta are un electrod pozitiv și unul negativ.
BaO este plasat pe electrozii lămpii. Electronii pe care îi emite se ciocnesc cu atomii vaporilor metalului și le transmit energie..
Când un curent electric trece prin acest gaz sau vapori, se produce lumină vizibilă sau radiație ultravioletă (UV)..
În fabricarea ceramicii
BaO este utilizat în compozițiile de acoperire cu glazură ceramică.

Cu toate acestea, a fost testat și ca aditiv în prepararea sticlei ceramice.
BaO îmbunătățește în mod eficient caracteristicile mecanice și rezistența chimică a acestui tip de ceramică. Are o influență puternică asupra proprietăților termice și a compoziției fazei cristaline a materialelor obținute..
La prepararea amestecurilor de ciment
BaO a fost testat ca component al cimentului fosfoaluminat.
Acest tip de ciment este util în mediile marine, deoarece nu are aceeași tendință de hidratare ca și alte tipuri de ciment, deci nu suferă de formarea sau expansiunea porilor..
Cu toate acestea, cimenturile cu fosfoaluminat trebuie consolidate în ceea ce privește performanța lor mecanică pentru a rezista curenților și loviturilor marine din bucățile de gheață plutitoare prezente în ocean..
Adăugarea de BaO la cimentul fosfoaluminat modifică structura minerală a materialului menționat, îmbunătățește structura porilor și mărește considerabil rezistența la compresiune a pastei de ciment..
Cu alte cuvinte, BaO îmbunătățește rezistența la compresiune a acestui tip de ciment..

În diverse aplicații
Este folosit ca ingredient pentru a oferi opacitate în rășinile dentare pentru umplerea găurilor din dinți, efectuate de către dentiști.
De asemenea, este utilizat ca agent de nuclere pentru prepararea polimerilor de fluorură de poliviniliden care sunt folosiți pentru izolarea cablurilor de alimentare..
Referințe
- Partyka, J. și colab. (2016). Efectul adăugării de BaO asupra sinterizării materialelor vitroceramice de la SiODouă-PentruDouăSAU3-N / ADouăBINEDouăSistem O-CaO / MgO. J Therm Anal Calorim (2016) 125: 1095. Recuperat de pe link.springer.com.
- Zhang, P. și colab. (2019). Efectul BaO asupra structurii minerale și comportamentul de hidratare a cimentului fosfoaluminat. J Therm Anal Calorim (2019) 136: 2319. Recuperat de pe link.springer.com.
- S.U.A. Biblioteca Națională de Medicină. (2019). Oxid de bariu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Iluminat. Principiu. În Cartea de referință a inginerului electric (ediția a șaisprezecea). Recuperat de la sciencedirect.com.
- Ebnesajjad, S. (2003). Spumă fluoropolimerică. PVDF spumant. În Fluoroplasticele procesabile în topitură. Recuperat de la sciencedirect.com.
- Stand, H.S. și McIntyre, L.H. (1930). Oxid de bariu ca deshidratant. Ind. Ing. Chem. Anal. Ed. 1930, 2, 1, 12-15. Recuperat de la pubs.acs.org.



Nimeni nu a comentat acest articol încă.