
Structura oxidului de zinc (ZnO), proprietăți, utilizări, riscuri

oxid de zinc Este un compus anorganic a cărui formulă chimică este ZnO. Se compune exclusiv din ioni ZnDouă+ pe mineDouă- într-un raport 1: 1; cu toate acestea, rețeaua sa cristalină poate prezenta un loc liber de ODouă-, ceea ce dă naștere unor defecte structurale capabile să modifice culorile cristalelor tale sintetice.
Este achiziționat comercial sub formă de solid alb praf (imagine inferioară), care este produs direct din oxidarea zincului metalic prin Procesul francez; sau supunerea minereurilor de zinc la reducerea carbotermică, în așa fel încât vaporii lor sunt apoi oxidați și ajung să se solidifice.

Alte metode de preparare a ZnO constau în precipitarea hidroxidului său, Zn (OH)Două, din soluții apoase de săruri de zinc. În mod similar, peliculele subțiri variate morfologic sau nanoparticulele de ZnO pot fi sintetizate folosind tehnici mai sofisticate, cum ar fi depunerea chimică a vaporilor săi..
Acest oxid metalic se găsește în natură ca zincit mineral, ale cărui cristale sunt de obicei galbene sau portocalii datorită impurităților metalice. Cristalele ZnO se caracterizează prin faptul că sunt piezoelectrice, termocromice, luminescente, polare și au, de asemenea, o bandă de energie foarte largă în proprietățile lor semiconductoare..
Structural este izomorf la sulfura de zinc, ZnS, adoptând cristale hexagonale și cubice similare cu cele ale wurzitei, respectiv blendei. În acestea există un anumit caracter covalent în interacțiunile dintre ZnDouă+ pe mineDouă-, ceea ce determină o distribuție eterogenă a sarcinilor în cristalul ZnO.
Studiile privind proprietățile și utilizările ZnO se extind la domeniile fizicii, electronicii și biomedicinei. Utilizările sale cele mai simple și de zi cu zi trec neobservate în compoziția cremelor faciale și a produselor de igienă personală, precum și în protecția solară.
Indice articol
- 1 Structură
- 1.1 Polimorfi
- 1.2 Interacțiuni
- 1.3 Morfologia nanoparticulelor
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Punctul de topire
- 2.4 Densitatea
- 2.5 Solubilitate în apă
- 2.6 Amfotericism
- 2.7 Capacitatea de căldură
- 2.8 Decalaj energetic direct
- 3 utilizări
- 3.1 Medicamentos
- 3.2 Antibacterian
- 3.3 Pigmenți și acoperiri
- 3.4 Bioimagini
- 3.5 Aditiv
- 3.6 Eliminator de sulfură de hidrogen
- 4 Riscuri
- 5 Referințe
Structura
Polimorfe
ZnO cristalizează în condiții normale de presiune și temperatură într-o structură hexagonală de wurzit. În această structură, ionii ZnDouă+ pe mineDouă- sunt dispuse în straturi alternante, astfel încât fiecare să ajungă înconjurat de un tetraedru, cu ZnO4 sau OZn4, respectiv.
De asemenea, utilizând un „șablon” sau suport cubic, ZnO poate fi făcut să cristalizeze într-o structură cubică de blendă de zinc; care, la fel ca wurzita, corespund structurilor izomorfe (identice în spațiu, dar cu ioni diferiți) de sulfură de zinc, ZnS.
În plus față de aceste două structuri (wurzite și blendă), ZnO sub presiune ridicată (în jur de 10 GPa) cristalizează în structura sării de rocă, la fel ca cea a NaCl.
Interacțiuni
Interacțiuni între ZnDouă+ pe mineDouă- prezintă un anumit caracter de covalență, deci există parțial o legătură covalentă Zn-O (ambii atomi cu hibridizare sp3), și datorită distorsiunii tetraedrelor, ele manifestă un moment dipol care se adaugă atracțiilor ionice ale cristalelor ZnO.
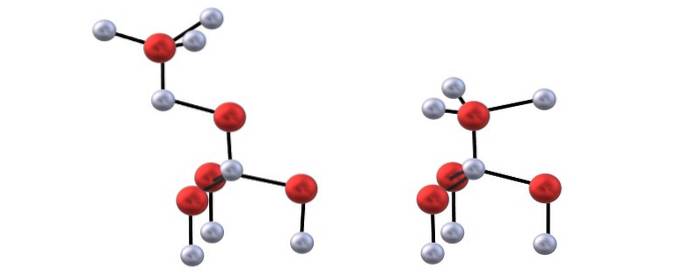
Aveți imaginea superioară pentru a vizualiza tetraedrul menționat pentru structurile ZnO.
Diferența dintre structurile blenda și wurzite constă și în faptul că, văzuți de sus, ionii nu sunt eclipsați. De exemplu, în wurzite, se apreciază că sferele albe (ZnDouă+) sunt chiar deasupra sferelor roșii (ODouă-). Pe de altă parte, în structura cubică a blendei acest lucru nu se întâmplă deoarece există trei straturi: A, B și C în loc de doar două.
Morfologia nanoparticulelor
Deși cristalele ZnO tind să aibă structuri hexagonale de wurzite, morfologia nanoparticulelor lor este o altă poveste. În funcție de parametri și metode de sinteză, acestea pot lua forme la fel de variate precum tije, plăci, frunze, sfere, flori, curele, ace, printre altele..
Proprietăți
Aspectul fizic
Solid alb, inodor, praf cu gust amar. În natură poate fi găsit cristalizat, cu impurități metalice, cum ar fi mineralul de zincită. Dacă astfel de cristale sunt albe, ele prezintă termocromism, ceea ce înseamnă că, atunci când sunt încălzite, își schimbă culoarea: de la alb la galben..
De asemenea, cristalele sale sintetice pot prezenta culori roșiatice sau verzui în funcție de compoziția lor de oxigen stoichiometric; adică lacunele sau posturile vacante cauzate de lipsa anionilor ODouă- afectează direct modul în care lumina interacționează cu rețelele ionice.
Masă molară
81,406 g / mol
Punct de topire
1974 ° C. La această temperatură suferă descompunere termică eliberând vapori de zinc și oxigen molecular sau gazos..
Densitate
5,1 g / cm3
Solubilitatea apei
ZnO este practic insolubil în apă, provocând cu greu soluții cu o concentrație de 0,0004% la 18 ° C.
Amfotericism
ZnO poate reacționa atât cu acizi, cât și cu baze. Când reacționează cu un acid în soluție apoasă, solubilitatea sa crește formând o sare solubilă în care ZnDouă+ ajunge să se complexeze cu molecule de apă: [Zn (OHDouă)6]Două+. De exemplu, reacționează cu acidul sulfuric pentru a produce sulfat de zinc:
ZnO + HDouăSW4 → ZnSO4 + HDouăSAU
În mod similar, reacționează cu acizii grași pentru a forma sărurile lor respective, cum ar fi stearatul de zinc și palmitatul..
Și când reacționează cu o bază, în prezența apei, se formează sărurile de zinc:
ZnO + 2NaOH + HDouăO → NaDouă[Zn (OH)4]
Capacitate de căldură
40,3 J / K mol
Decalaj energetic direct
3,3 eV. Această valoare îl face un semiconductor în bandă largă, capabil să funcționeze sub câmpuri electrice intense. De asemenea, are caracteristici de a fi un semiconductor de acest tip n, care nu a putut explica motivele pentru care există o contribuție suplimentară a electronilor în structura sa.
Acest oxid se distinge prin proprietățile sale optice, acustice și electronice, datorită cărora este considerat un candidat pentru potențiale aplicații legate de dezvoltarea dispozitivelor optoelectronice (senzori, diode laser, celule fotovoltaice). Motivul pentru astfel de proprietăți este dincolo de domeniul fizicii.
Aplicații
Medicinal
Oxidul de zinc a fost folosit ca aditiv în numeroase creme albe pentru tratamentul iritațiilor, acne, dermatite, abraziuni și crăpături ale pielii. În această zonă, utilizarea sa este populară pentru ameliorarea iritațiilor cauzate de scutece pe pielea bebelușilor..
Este, de asemenea, o componentă a produselor de protecție solară, deoarece împreună cu nanoparticulele de dioxid de titan, TiODouă, Ajută la blocarea radiațiilor ultraviolete ale soarelui, de asemenea, acționează ca un agent de îngroșare, motiv pentru care se găsește în anumite machiaje ușoare, loțiuni, emailuri, talcuri și săpunuri..
Pe de altă parte, ZnO este o sursă de zinc utilizat în suplimentele alimentare și produsele vitaminice, precum și în cereale..
Antibacterian
Conform morfologiei nanoparticulelor sale, ZnO poate fi activat sub radiații ultraviolete pentru a genera peroxizi de hidrogen sau specii reactive care slăbesc membranele celulare ale microorganismelor.
Când se întâmplă acest lucru, nanoparticulele ZnO rămase brazdează citoplasma și încep să interacționeze cu compendiul de biomolecule care alcătuiesc celula, rezultând apoptoza lor..
De aceea nu toate nanoparticulele pot fi utilizate în compozițiile de protecție solară, ci doar cele care nu au activitate antibacteriană..
Produsele cu acest tip de ZnO sunt proiectate, acoperite cu materiale polimerice solubile, pentru a trata infecții, răni, ulcere, bacterii și chiar diabet..
Pigmenți și acoperiri
Pigmentul cunoscut sub numele de zinc alb este ZnO, care se adaugă la diferite vopsele și acoperiri pentru a proteja suprafețele metalice acolo unde sunt aplicate de coroziune. De exemplu, acoperirile cu adaos de ZnO sunt utilizate pentru a proteja fierul galvanizat..
Pe de altă parte, aceste acoperiri au fost utilizate și pe geamul ferestrei pentru a împiedica pătrunderea căldurii (dacă este în exterior) sau pătrunderea (dacă este în interior). De asemenea, protejează unele materiale polimerice și textile de deteriorarea cauzată de acțiunea radiației solare și a căldurii..
Bioimagini
Luminiscența nanoparticulelor ZnO a fost studiată pentru a fi utilizată în bioimagistică, studiind astfel structurile interne ale celulelor prin luminile albastre, verzi sau portocalii care radiază..
Aditiv
ZnO găsește, de asemenea, utilizarea ca aditiv în cauciucuri, cimenturi, materiale dentifrice, pahare și ceramică, datorită punctului său de topire mai scăzut și, prin urmare, comportându-se ca agent de flux..
Eliminator de sulfură de hidrogen
ZnO elimină gazele H neplăcuteDouăDa, ajutând la desulfurarea unor vapori:
ZnO + HDouăS → ZnS + HDouăSAU
Riscuri
Oxidul de zinc ca atare este un compus netoxic și inofensiv, astfel încât manipularea prudentă a solidului său nu reprezintă niciun risc..
Cu toate acestea, problema rezidă în fumul său, deoarece, deși se descompune la temperaturi ridicate, vaporii de zinc ajung să contamineze plămânii și să provoace un fel de „febră metalică”. Această boală se caracterizează prin simptome de tuse, febră, senzație de strângere în piept și un gust metalic constant în gură..
De asemenea, nu este cancerigen, iar cremele care îl conțin nu s-au dovedit a crește absorbția zincului în piele, astfel încât produsele de protecție solară pe bază de ZnO sunt considerate sigure; cu excepția cazului în care există reacții alergice, caz în care utilizarea acestuia trebuie oprită.
În ceea ce privește anumite nanoparticule concepute pentru a combate bacteriile, acestea ar putea avea efecte negative dacă nu sunt transportate corect la locul lor de acțiune..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Oxid de zinc. Recuperat de pe: en.wikipedia.org
- Hadis Morkoç și Ümit Özgur. (2009). Oxid de zinc: elemente de bază, materiale și tehnologia dispozitivelor. [PDF]. Recuperat de la: application.wiley-vch.de
- Parihar, M. Raja și R. Paulose. (2018). O scurtă revizuire a proprietăților structurale, electrice și electrochimice ale nanoparticulelor de oxid de zinc. [PDF]. Recuperat de pe: ipme.ru
- A. Rodnyi și I. V. Khodyuk. (2011). Proprietăți optice și de luminiscență ale oxidului de zinc. Recuperat de pe: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin și Husen, A. (2018). Proprietățile nanoparticulelor de oxid de zinc și activitatea lor împotriva microbilor. Scrisori de cercetare la scară nano, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- Fapte chimice de siguranță. (2019). Oxid de zinc. Recuperat de la: chemicalafetyfacts.org
- Jinhuan Jiang, Jiang Pi și Jiye Cai. (2018). Progresarea nanoparticulelor de oxid de zinc pentru aplicații biomedicale. Chimie bioinorganică și aplicații, vol. 2018, ID articol 1062562, 18 pagini. doi.org/10.1155/2018/1062562


Nimeni nu a comentat acest articol încă.