
Structura, proprietățile și utilizările oxidului de argint (Ag2O)
oxid de argint este un compus anorganic a cărui formulă chimică este AgDouăO. Forța care își leagă atomii are natura în întregime ionică; prin urmare, este format dintr-un solid ionic în care există o proporție de doi cationi Ag+ interacționând electrostatic cu un anion ODouă-.
Anionul oxid, ODouă-, Rezultă din interacțiunea atomilor de argint de la suprafață cu oxigenul din mediu. la fel ca și fierul și multe alte metale. În loc să se înroșească și să se prăbușească în rugină, o bucată sau bijuterie de argint devine neagră, caracteristică oxidului de argint..

De exemplu, în imaginea de mai sus puteți vedea o ceașcă de argint oxidată. Rețineți suprafața înnegrită, deși păstrează încă o strălucire ornamentală; motiv pentru care chiar și obiectele de argint oxidate pot fi considerate suficient de atractive pentru utilizări decorative.
Proprietățile oxidului de argint sunt astfel încât, la prima vedere, să nu mănânce suprafața metalică originală. Se formează la temperatura camerei prin simplul contact cu oxigenul din aer; și chiar mai interesant, se poate descompune la temperaturi ridicate (peste 200 ° C).
Aceasta înseamnă că, dacă sticla din imagine ar fi înțeleasă și ar fi fost aplicată căldura unei flăcări intense, aceasta și-ar recâștiga strălucirile de argint. Prin urmare, formarea sa este un proces reversibil termodinamic..
Oxidul de argint are și alte proprietăți și, dincolo de simpla sa formulă AgDouăSau cuprinde organizații structurale complexe și o bogată varietate de solide. Cu toate acestea, AgDouăSau este poate, lângă AgDouăSAU3, cel mai reprezentativ al oxizilor de argint.
Indice articol
- 1 Structura oxidului de argint
- 1.1 Modificări cu numărul de valență
- 2 Proprietăți fizice și chimice
- 2.1 Greutatea moleculară
- 2.2 Aspect
- 2.3 Densitatea
- 2.4 Punct de topire
- 2,5 Kps
- 2.6 Solubilitate
- 2.7 Caracter covalent
- 2.8 Descompunerea
- 3 Nomenclatură
- 3.1 Valențele I și III
- 3.2 Nomenclatura sistematică pentru oxizii de argint complexi
- 4 utilizări
- 5 Referințe
Structura oxidului de argint
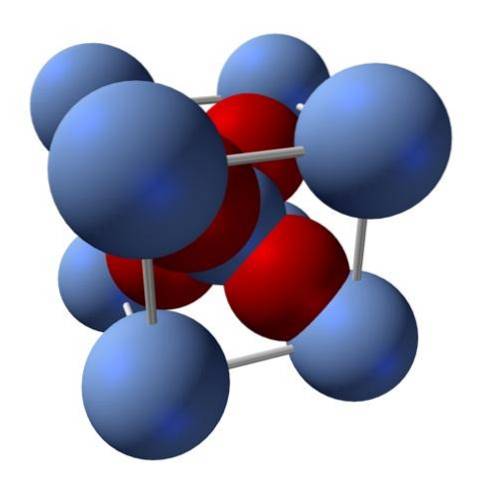
Cum este structura sa? După cum sa menționat la început: este un solid ionic. Din acest motiv, în structura sa nu pot exista nici legături covalente Ag - O, nici Ag = O; întrucât, dacă ar exista, proprietățile acestui oxid s-ar schimba drastic. Este atunci ionii Ag+ pe mineDouă- într-un raport 2: 1 și experimentând atracție electrostatică.
În consecință, structura oxidului de argint este determinată de modul în care forțele ionice aranjează ionii Ag în spațiu.+ pe mineDouă-.
În imaginea de mai sus, de exemplu, există o celulă unitară pentru un sistem de cristal cubic: cationii Ag+ sunt sferele albastru-argintiu și ODouă- sferele roșiatice.
Dacă se numără numărul de sfere, se va constata că există, cu ochiul liber, nouă albastru argintiu și patru roșu. Cu toate acestea, sunt luate în considerare doar fragmentele sferelor conținute în interiorul cubului; numărându-le, fiind fracții din sferele totale, raportul 2: 1 pentru Ag trebuie îndeplinitDouăSAU.
Repetarea unității structurale a tetraedrului AgO4 înconjurat de alte patru Ag+, se construiește întregul solid negru (evitând golurile sau neregulile pe care le pot avea aceste aranjamente cristaline).
Modificări cu numărul de valență
Concentrându-ne acum nu pe tetraedrul AgO4 dar pe linia AgOAg (observați vârfurile cubului superior), se va vedea că solidul de oxid de argint constă, dintr-o altă perspectivă, din mai multe straturi de ioni dispuși liniar (deși înclinați). Toate acestea ca urmare a geometriei „moleculare” din jurul Ag+.
Acest lucru a fost confirmat de mai multe studii asupra structurii sale ionice..
Argintul funcționează predominant cu valența +1, deoarece la pierderea unui electron configurația sa electronică rezultată este [Kr] 4d10, care este foarte stabil. Alte valențe, cum ar fi AgDouă+ și Ag3+ acestea sunt mai puțin stabile, deoarece pierd electroni din orbitali aproape plini.
Ag ionul3+, cu toate acestea, este relativ mai puțin instabil în comparație cu AgDouă+. De fapt, poate coexista în compania Ag+ îmbogățind chimic structura.
Configurația sa de electroni este [Kr] 4d8, cu electroni neperecheați în așa fel încât să îi ofere o oarecare stabilitate.
Spre deosebire de geometriile liniare din jurul ionilor Ag+, s-a constatat că cel al ionilor Ag3+ este plan pătrat. Prin urmare, un oxid de argint cu ioni Ag3+ ar consta din straturi compuse din pătrate de AgO4 (nu tetraedre) legate electrostatic de linii AgOAg; acesta este cazul Ag4SAU4 sau AgDouăO ∙ AgDouăSAU3 cu structură monoclinică.
Proprietati fizice si chimice

Răzuirea suprafeței cupei de argint din imaginea principală ar avea ca rezultat un solid, care nu este doar de culoare neagră, dar are și nuanțe de maro sau maro (imaginea de sus). Unele dintre proprietățile sale fizice și chimice raportate în acest moment sunt următoarele:
Greutate moleculară
231,735 g / mol
Aspect
Solid negru-maro sub formă de pulbere (rețineți că, în ciuda faptului că este un solid ionic, îi lipsește un aspect cristalin). Este inodor și amestecat cu apă îi conferă un gust metalic
Densitate
7,14 g / ml.
Punct de topire
277-300 ° C. Cu siguranță se topește în argint solid; adică probabil se descompune înainte de a forma oxidul lichid.
Kps
1,52 ∙ 10-8 în apă la 20 ° C. Prin urmare, este un compus greu solubil în apă.
Solubilitate
Dacă vă uitați atent la imaginea structurii sale, veți descoperi că sferele AgDouă+ pe mineDouă- nu se deosebesc aproape ca mărime. Acest lucru are ca rezultat faptul că numai moleculele mici pot trece prin interiorul rețelei cristaline, făcându-l insolubil în aproape toți solvenții; cu excepția celor în care reacționează, cum ar fi bazele și acizii.
Caracter covalent
Deși s-a spus în mod repetat că oxidul de argint este un compus ionic, anumite proprietăți, cum ar fi punctul său scăzut de topire, contrazic această afirmație..
Cu siguranță, luarea în considerare a caracterului covalent nu distruge ceea ce a fost explicat pentru structura sa, deoarece ar fi suficient să adăugați în structura AgDouăSau un model de sfere și bare pentru a indica legături covalente.
La fel, tetraedrul și planurile pătrate AgO4, precum și liniile AgOAg, acestea ar fi legate prin legături covalente (sau covalente ionice).
Având în vedere acest lucru, AgDouăSau ar fi de fapt un polimer. Cu toate acestea, este recomandat să-l considerăm ca un solid ionic cu caracter covalent (a cărui natură a legăturii este și astăzi o provocare).
Descompunere
La început s-a menționat că formarea sa este reversibilă termodinamic, deci absoarbe căldura pentru a reveni la starea sa metalică. Toate acestea pot fi exprimate prin două ecuații chimice pentru astfel de reacții:
4Ag (s) + ODouă(g) => 2AgDouăO (s) + Q
2AgDouăO (s) + Q => 4Ag (s) + ODouă(g)
Unde Q reprezintă căldura în ecuație. Acest lucru explică de ce focul care arde suprafața cupei de argint oxidat o readuce la strălucirea sa argintie..
Prin urmare, este dificil de presupus că există AgDouăO (l) deoarece s-ar descompune instantaneu din căldură; Cu excepția cazului în care presiunea este crescută prea mult pentru a obține lichidul negru maro.
Nomenclatură
Când s-a introdus posibilitatea ionilor AgDouă+ și Ag3+ pe lângă Ag. comună și predominantă+, termenul „oxid de argint” începe să pară insuficient pentru a se referi la AgDouăSAU.
Acest lucru se datorează faptului că ionul Ag+ este mai abundent decât celelalte, deci Ag este luatDouăSau ca singurul oxid; ceea ce nu este deloc corect.
Dacă AgDouă+ întrucât este practic inexistent dată fiind instabilitatea sa, vom avea doar ionii cu valențe +1 și +3; adică Ag (I) și Ag (III).
Valencias I și III
Deoarece Ag (I) este cel cu cea mai mică valență, acesta este numit prin adăugarea sufixului -oso la numele său argentum. Astfel, AgDouăOri este: oxid de argint sau, conform nomenclaturii sistematice, monoxid de diplomat.
Dacă Ag (III) este complet ignorat, atunci nomenclatura sa tradițională ar trebui să fie: oxid de argint în loc de oxid de argint.
Pe de altă parte, Ag (III) fiind cea mai mare valență, sufixului -ico i se adaugă numele. Astfel, AgDouăSAU3 este: oxid de argint (2 ioni Ag3+ cu trei O.Două-). De asemenea, denumirea sa conform nomenclaturii sistematice ar fi: trioxid de diplata.
Dacă structura AgDouăSAU3, se poate presupune că este produsul oxidării cu ozon, SAU3, în loc de oxigen. Prin urmare, caracterul său covalent trebuie să fie mai mare deoarece este un compus covalent cu legături Ag-O-O-O-Ag sau Ag-O.3-Ag.
Nomenclatura sistematică pentru oxizii de argint complexi
AgO, scris și ca Ag4SAU4 sau AgDouăO ∙ AgDouăSAU3, Este un oxid de argint (I, III), deoarece are atât valențe +1, cât și +3. Denumirea sa conform nomenclaturii sistematice ar fi: tetraoxid de argint.
Această nomenclatură este de mare ajutor atunci când vine vorba de alți oxizi de argint complexi din punct de vedere stoichiometric. De exemplu, să presupunem că cele două solide 2AgDouăO ∙ AgDouăSAU3 și AgDouăO ∙ 3AgDouăSAU3.
Scrierea primului mai adecvat ar fi: Ag6SAU5 (numărarea și adăugarea atomilor de Ag și O). Numele său ar fi atunci pentoxid de hexaplată. Rețineți că acest oxid are o compoziție de argint mai puțin bogată decât AgDouăSau (6: 5 < 2:1).
În timp ce scriem al doilea solid într-un alt mod, ar fi: Ag8SAU10. Numele său ar fi decaoxid octa-argintiu (cu un raport 8:10 sau 4: 5). Acest ipotetic oxid de argint ar fi „foarte oxidat”.
Aplicații
Studiile în căutarea unor utilizări noi și sofisticate pentru oxidul de argint continuă până în prezent. Unele dintre utilizările sale sunt enumerate mai jos:
-Se dizolvă în amoniac, azotat de amoniu și apă pentru a forma reactivul Tollens. Acest reactiv este un instrument util în analiza calitativă în laboratoarele de chimie organică. Permite determinarea prezenței aldehidelor într-o probă, cu formarea unei „oglinzi de argint” în eprubetă ca răspuns pozitiv..
-Împreună cu zincul metalic, formează bateriile primare de oxid de zinc-argint. Aceasta este probabil una dintre cele mai comune și utilizări casnice.
-Acesta servește ca purificator de gaze, absorbind de exemplu CODouă. Când este încălzit, eliberează gaze prinse și poate fi refolosit de mai multe ori.
-Datorită proprietăților antimicrobiene ale argintului, oxidul său este util în bioanaliză și studii de purificare a solului..
-Este un agent oxidant ușor capabil să oxideze aldehidele în acizi carboxilici. Este, de asemenea, utilizat în reacția Hofmann (a aminelor terțiare) și participă la alte reacții organice, fie ca reactiv, fie ca catalizator..
Referințe
- Bergstresser M. (2018). Oxid de argint: Formula, descompunere și formare. Studiu. Recuperat de la: study.com
- Autori și editori ai volumelor III / 17E-17F-41C. (s.f.). Oxizi de argint (Ag (x) O (y)) structură cristalină, parametri de rețea. (Date numerice și relații funcționale în știință și tehnologie), vol 41C. Springer, Berlin, Heidelberg.
- Mahendra Kumar Trivedi, Rama Mohan Tallapragada, Alice Branton, Dahryn Trivedi, Gopal Nayak, Omprakash Latiyal, Snehasis Jana. (2015). Impactul potențial al tratamentului energetic biocâmp asupra proprietăților fizice și termice ale pulberii de oxid de argint. Revista internațională de științe și inginerie biomedicale. Vol. 3, nr. 5, pp. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Sullivan R. (2012). Descompunerea oxidului de argint. Universitatea din Oregon. Recuperat de la: chemdemos.uoregon.edu
- Flint, Deyanda. (24 aprilie 2014). Utilizări ale bateriilor cu oxid de argint. Știința. Recuperat de pe: sciencing.com
- Salman Montasir E. (2016). Studiul unor proprietăți optice ale oxidului de argint (Ag2o) folosind spectrofotometrul UV. [PDF]. Recuperat de pe: iosrjournals.org
- Bard Allen J. (1985). Potențial standard în soluție apoasă. Marcel Dekker. Recuperat de la: books.google.co.ve

Nimeni nu a comentat acest articol încă.