
Formula oxidului plumbos (PbO), proprietăți, riscuri și utilizări

rugina plumbă, Oxidul de plumb (II) sau monoxidul de plumb este un compus chimic cu formula PbO. Se găsește în două polimorfe: litharge și masicotite. Structura sa este ilustrată în figura 1.
Revenind la compoziție, încărcătura este produsul oxidat din plumb topit care a fost agitat sau atomizat pentru a încorpora aer, apoi răcit și măcinat pentru a forma pulberea galbenă..
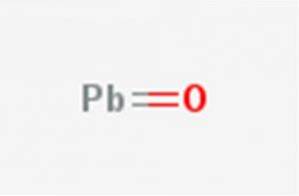
Denumirea de masicotită este utilizată atât pentru mineralul nativ, cât și pentru produsul cu monoxid de plumb produs prin încălzirea carbonatului de plumb la 300 ° C (monoxid de plumb, 2016). Aceste minerale sunt prezentate în figura 2.

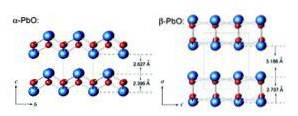
Masicotitul are o structură ortorombică în timp ce încărcătura are o structură cristalină tetragonală. Oxidul de plumb (II) are capacitatea de a schimba structura atunci când este încălzit sau răcit. Aceste structuri sunt prezentate în figura 3.
PbO este produs prin oxidarea plumbului metalic. Metalul este topit pentru a face tablete de plumb, iar apoi sunt măcinate între 170 ~ 210 ° C și trecute prin flacără pentru oxidare la temperaturi peste 600 ℃. Produsele oxidice sunt zdrobite pentru a obține oxidul de plumb finit (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
PbO este produs pe scară largă ca intermediar în rafinarea minereurilor de plumb în plumb metalic. Mineralul de plumb utilizat este galena (sulfura de plumb (II)). La temperatură ridicată (1000 ° C) sulfura este transformată în oxid după cum urmează:
2PbS + 3O2 → 2PbO + 2SO2
Indice articol
- 1 Proprietățile fizice și chimice ale ruginii plumb
- 2 Reactivitate și pericole
- 3 utilizări
- 4 Referințe
Proprietăți fizice și chimice ale oxidului plumbos
Monoxidul de plumb poate prezenta două apariții diferite: sub formă de pulbere galbenă uscată cu structură ortorombică (masicotită) sau sub formă de cristale tetragonale roșiatice (încărcătură). Ambele moduri sunt ilustrate în figura 4.

Compusul are o greutate moleculară de 223,20 g / mol și o densitate de 9,53 g / ml. Are un punct de topire de 888 ° C și un punct de fierbere de 1470 ° C (Centrul Național pentru Informații despre Biotehnologie, S.F.).
Compusul este foarte puțin solubil în apă, fiind capabil să se dizolve doar 0,0504 grame pe litru la 25 ° C sub formă de masicotită și 0,1065 grame pe litru la 25 ° C sub formă de litharge. Compusul este, de asemenea, insolubil în alcool. Este solubil în acid acetic, HNO3 diluat și alcali (Royal Society of Chemistry, 2015).
Compusul este un agent de oxidare sau reducere slab, cu toate acestea, pot apărea în continuare reacții redox. Acești compuși nu sunt reactivi la apă.
Oxidul de plumb oxidează carbura de aluminiu cu incandescență atunci când este încălzit. Amestecurile de oxid de plumb cu praf de aluminiu (ca și în cazul altor metale: sodiu, zirconiu) provoacă o explozie violentă.
Reactivitate și pericole
Monoxidul de plumb este un compus clasificat ca otrăvitor. Substanța este toxică pentru sistemul nervos central și poate fi cancerigenă la om (Fișă tehnică de securitate Material oxid de plumb, galben, 2013).
Simptomul de otrăvire timpurie este liniile de plumb care apar pe marginea gingiilor, iar pielea devine gri. Sindromul neurastenic va apărea și în perioada inițială de envenomare..
Intoxicația cerebelară poate avea ca rezultat depresia otrăvirii cu plumb, mania otrăvirii cu plumb, precum și toxicitatea plumbului și sensibilitatea la paralizia neuritei multiple.
Intoxicația cu plumb poate provoca, de asemenea, anemie hipocromă și tulburări endocrine și metabolice. În plus, otrăvirea cu plumb poate inhiba activitatea anumitor enzime din sistemul digestiv și poate provoca indigestie, dureri abdominale severe și leziuni hepatice. De asemenea, poate provoca hipertensiune arterială și creșterea colesterolului..
Dacă există dureri abdominale severe, pot fi luate unele măsuri, cum ar fi, injectarea subcutanată de atropină și alte medicamente, abdominale fierbinți, clisme, baie fierbinte și așa mai departe. Concentrația maximă permisă în aer este de 0,01 mg / m3 (monoxid de plumb, 2016).
În caz de contact cu ochii sau cu pielea, acesta trebuie spălat cu multă apă. În caz de inhalare sau ingestie, victima trebuie dusă într-un loc ventilat. Vărsăturile nu trebuie induse. Dacă victima nu respiră, trebuie administrată resuscitarea gură la gură.
În toate cazurile, trebuie solicitată asistență medicală imediată. Monoxidul de plumb este un compus dăunător pentru mediu, bioacumularea acestei substanțe chimice poate apărea la plante și mamifere.
Se recomandă insistent ca această substanță să nu pătrundă în mediu, deci trebuie manipulată și depozitată în conformitate cu prevederile stabilite (Institutul Național pentru Sănătate și Securitate în Muncă, 2015).
Aplicații
Monoxidul de plumb a fost folosit ca un uscător de vopsea și ca un flux redus de foc în fabricarea ceramicii și sticlei. Sticla din cristal de plumb este utilizată la fabricarea veselei de înaltă calitate.
Folosind monoxidul de plumb ca flux, este posibil să se obțină un pahar cu un indice de refracție ridicat și, în consecință, luminozitatea dorită (British Encyclopedia, 2016).
Conductoarele ceramice semi-metalice au cele mai mari conductivități dintre toate ceramica, cu excepția celor supraconductoare. Oxidul de plumb este un exemplu al acestui tip de ceramică semimetalică. Aceste materiale au benzi de energie electronice suprapuse și, prin urmare, sunt conductori electronici excelenți (Mason, 2008).
Oxidul de plumb este utilizat în principal în tuburile de electroni, tuburile de imagine, sticla optică, sticla de plumb anti-raze X și cauciucurile rezistente la radiații..
Este folosit ca reactiv analitic, fluxul de silicat, dar și pentru precipitarea aminoacizilor
Oxidul de plumb este utilizat la fabricarea stabilizatorului din plastic din PVC și este, de asemenea, materia primă pentru alte săruri de plumb. Este, de asemenea, utilizat în rafinarea petrolului și pentru determinarea aurului și argintului..
Este, de asemenea, utilizat ca pigment galben în vopsele și emailuri. Masicotitul a fost folosit ca pigment de către artiștii din secolele XV-XVIII.
Straturile subțiri de monoxid de plumb sunt utilizate pentru a produce culori irizate în alamă și bronz. Litarga este amestecată cu glicerol pentru a face cimentul instalatorului.
Referințe
- Enciclopedia Britanică. (2016, 10 octombrie). Sticlă. Recuperat de la britannica: britannica.com.
- Kirk-Othmer. (o mie noua sute nouazeci si cinci). Enciclopedia Tehnologiei Chimice. A 4-a ed. Volumele 1. New York: John Wiley și Sons.
- Monoxid de plumb. (2016, 1 mai). Recuperat de la cameo.mfa: cameo.mfa.org.
- Monoxid de plumb. (2016). Recuperat de pe Chemicalbook: chemicalbook.com.
- Mason, T. O. (2008, 12 martie). Ceramica conductivă. Recuperat de la britannica: britannica.com.
- Fișă tehnică de securitate Oxid de plumb, galben. (2013, 21 mai). Recuperat de la sciencelab: sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (S.F.). Baza de date compusă PubChem; CID = 14827. Recuperat de la PubChem: pubchem.ncbi.nlm.nih.gov.
- Institutul Național pentru Securitate și Sănătate în Muncă. (2015, 22 iulie). OXID DE PLUMB (II). Recuperat de la cdc.gov: cdc.gov.
- Societatea Regală de Chimie. (2015). Oxid de plumb (II). Recuperat de la chemspider: chemspider.com.



Nimeni nu a comentat acest articol încă.