
Structura moleculelor amfipatice, caracteristici, exemple
molecule amfipatice sau amfipilice Sunt cei care pot simți afinitate sau respingere în același timp pentru un anumit solvent. Solvenții sunt clasificați chimic ca fiind polari sau apolari; hidrofil sau hidrofob. Astfel, aceste tipuri de molecule pot „iubi” apa, la fel cum o pot „urâ”..
Conform definiției anterioare, există o singură modalitate prin care acest lucru să fie posibil: aceste molecule trebuie să aibă regiuni polare și apolare în structurile lor; Fie sunt distribuite mai mult sau mai puțin omogen (cum este cazul proteinelor, de exemplu), fie sunt localizate eterogen (în cazul surfactanților)

Surfactanții, numiți și detergenți, sunt probabil cele mai cunoscute molecule amfipatice din toate timpurile. De când Omul a fost captivat de fizionomia ciudată a unei bule, îngrijorat de prepararea săpunurilor și a produselor de curățare, el a dat peste tot fenomenul tensiunii superficiale..
Observarea unei bule este la fel ca a asista la o „capcană” ai cărei pereți, formați prin alinierea moleculelor amfipatice, rețin conținutul gazos al aerului. Formele sale sferice sunt cele mai stabile din punct de vedere matematic și geometric, deoarece reduc la minimum tensiunea superficială a interfeței aer-apă..
Acestea fiind spuse, au fost discutate alte două caracteristici ale moleculelor amfipatice: acestea tind să se asocieze sau să se auto-asambleze și unele tensiuni superficiale mai mici în lichide (cele care pot face acest lucru se numesc surfactanți).
Ca urmare a tendinței ridicate de asociere, aceste molecule deschid un câmp de studiu morfologic (și chiar arhitectural) al nanoagregatelor și supramoleculelor care le compun; cu scopul de a proiecta compuși care pot fi funcționalizați și interacționa în moduri incomensurabile cu celulele și matricile lor biochimice.
Indice articol
- 1 Structură
- 1.1 Interacțiuni intermoleculare
- 1.2 Diverse
- 2 Caracteristicile moleculelor amfipatice
- 2.1 Asocierea
- 2.2 Fizic
- 3 Exemple
- 4 Aplicații
- 4.1 Membranele celulare
- 4.2 Dispersanți
- 4.3 Emulgatori
- 4.4 Detergenți
- 4.5 Antioxidanți
- 5 Referințe
Structura
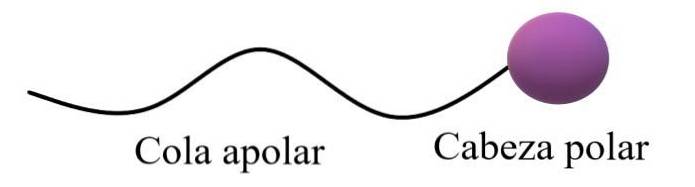
S-a spus că moleculele amfifile sau amfipatice au o regiune polară și o regiune apolară. Regiunea apolară constă de obicei dintr-un lanț de carbon saturat sau nesaturat (cu legături duble sau triple), care este reprezentat ca o „coadă apolară”; însoțit de un „cap polar”, în care locuiesc cei mai electronomi atomici.
Structura generală superioară ilustrează comentariile din paragraful anterior. Capul polar (sfera purpurie) poate fi grupuri funcționale sau inele aromatice care au momente dipolare permanente și sunt, de asemenea, capabile să formeze legături de hidrogen. Prin urmare, cel mai ridicat conținut de oxigen și azot ar trebui să fie localizat acolo.
În acest cap polar pot exista, de asemenea, sarcini ionice, negative sau pozitive (sau ambele în același timp). Această regiune este cea care prezintă o afinitate mare pentru apă și alți solvenți polari..
Pe de altă parte, coada apolară, având în vedere legăturile sale predominante C-H, interacționează prin forțele de împrăștiere ale Londrei. Această regiune este responsabilă de faptul că moleculele amfipatice prezintă și afinitate pentru grăsimi și molecule apolare din aer (NDouă, CODouă, Ar etc.).
În unele texte de chimie, modelul pentru structura superioară este comparat cu forma unei acadele.
Interacțiuni intermoleculare
Când o moleculă amfipatică intră în contact cu un solvent polar, să zicem apă, regiunile sale exercită efecte diferite asupra moleculelor solventului..
Pentru început, moleculele de apă caută să solvateze sau să hidrateze capul polar, stând departe de coada apolară. În acest proces se creează tulburări moleculare.
Între timp, moleculele de apă din jurul cozii apolare tind să se aranjeze ca și cum ar fi cristale mici, permițându-le astfel să minimizeze repulsiile. În acest proces se creează o ordine moleculară.
Între tulburări și ordine, va veni un moment în care molecula amfipatică va căuta să interacționeze cu alta, ceea ce va duce la un proces mult mai stabil..
Miscele
Ambele vor fi abordate prin cozile lor apolare sau prin capetele polare, în așa fel încât regiunile înrudite să interacționeze mai întâi. Acest lucru este la fel ca să ne imaginăm că două „acadele violete” din imaginea de mai sus, se apropie prin împletirea cozilor lor negre sau prin unirea celor două capete violete..
Și astfel începe un fenomen de asociere interesant, în care mai multe dintre aceste molecule sunt unite consecutiv. Ele nu sunt asociate în mod arbitrar, ci conform unei serii de parametri structurali, care ajung să izoleze cozile apolare într-un fel de „nucleu apolar”, expunând în același timp capetele polare ca o coajă polară..
Se spune atunci că s-a născut o miscelă sferică. Cu toate acestea, în timpul formării miscelei există o etapă preliminară constând în ceea ce este cunoscut sub numele de strat strat lipidic. Acestea și altele sunt unele dintre numeroasele macrostructuri pe care le pot adopta moleculele amfifile.
Caracteristicile moleculelor amfipatice
Asociere

Dacă cozile apolare sunt luate ca unități negre, iar capetele polare ca unități violete, se va înțelege de ce în imaginea superioară scoarța miscelei este purpurie și nucleul său este negru. Nucleul este apolar, iar interacțiunile sale cu moleculele de apă sau solvent sunt zero..
Dacă, pe de altă parte, solventul sau mediul este apolar, capetele polare vor suferi repulsiile și, în consecință, acestea vor fi situate în centrul miscelei; adică este inversat (A, imagine inferioară).
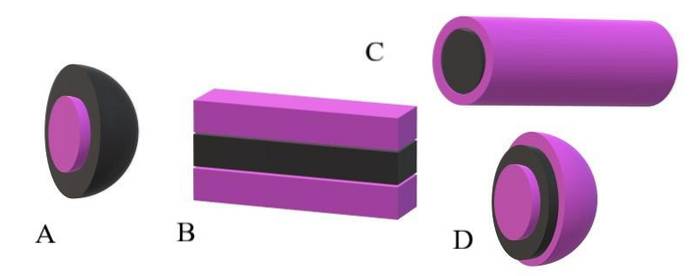
Se observă că miscela inversată are o coajă apolară neagră și un nucleu polar purpuriu. Dar, înainte de formarea miscelelor, moleculele amfifile se găsesc individual modificând ordinea moleculelor solventului. Concentrație crescută, încep să se asocieze într-o structură de unul sau două straturi (B).
Din B, lamelele încep să se curbeze pentru a forma D, o veziculă. O altă posibilitate, în funcție de forma cozii apolare față de capul său polar, este ca acestea să se asocieze pentru a da naștere unei miscele cilindrice (C).
Nanoagregate și supramolecule
Prin urmare, există cinci structuri principale, care dezvăluie o caracteristică fundamentală a acestor molecule: tendința lor ridicată de a se asocia și auto-asambla în supramolecule, care se agregă pentru a forma nanoagregate..
Astfel, moleculele amfifile nu se găsesc singure, ci în asociere..
Fizic
Moleculele amfipatice pot fi neutre sau încărcate ionic. Cei care au sarcini negative au un atom de oxigen cu o sarcină formală negativă în capul polar. Unii dintre acești atomi de oxigen provin din grupuri funcționale precum: -COO-, -SW4-, -SW3- sau -PO4-.
În ceea ce privește sarcinile pozitive, acestea provin în general de la amine, RNH3+.
Prezența sau absența acestor sarcini nu schimbă faptul că aceste molecule formează în general solide cristaline; sau, dacă sunt relativ ușoare, se găsesc sub formă de uleiuri.
Exemple
Câteva exemple de molecule amfipatice sau amfifile vor fi menționate mai jos:
-Fofolipide: fosfatidiletanolamină, sfingomielină, fosfatidilserină, fosfatidilcolină.
-Colesterol.
-Glicolipide.
-Laurilsulfat de sodiu.
-Proteine (sunt amfifile, dar nu surfactanți).
-Grăsimi fenolice: cardanol, cardoli și acizi anacardici.
-Bromură de cetiltrimetilamoniu.
-Acizi grași: palmitic, linoleic, oleic, lauric, stearic.
-Alcooli cu lanț lung: 1-dodecanol și alții.
-Polimeri amfifili: cum ar fi rășinile fenolice etoxilate.
Aplicații
Membranele celulare
Una dintre cele mai importante consecințe ale abilității acestor molecule de a se asocia este că acestea construiesc un fel de perete: bistratul lipidic (B).
Acest strat strat se extinde pentru a proteja și regla intrarea și ieșirea compușilor în celule. Este dinamic, deoarece cozile sale apolare se rotesc ajutând moleculele amfipatice să se miște..
La fel, atunci când această membrană este atașată la două capete, pentru a o avea pe verticală, este utilizată pentru a măsura permeabilitatea acesteia; și cu aceasta, se obțin date valoroase pentru proiectarea materialelor biologice și a membranelor sintetice din sinteza noilor molecule amfipatice cu parametri structurali diferiți..
Dispersanti
În industria petrolieră, aceste molecule și polimerii sintetizați din acestea sunt folosite pentru a dispersa asfaltenii. Accentul acestei aplicații se bazează pe ipoteza că asfaltenele constau dintr-un solid coloidal, cu o tendință ridicată de floculare și sedimentare ca un solid maro-negru care cauzează probleme economice grave..
Moleculele amfipatice ajută la menținerea asfaltenelor dispersate pentru o perioadă mai lungă de timp în fața modificărilor fizico-chimice din brut..
Emulgatori
Aceste molecule ajută la amestecarea a două lichide care nu ar fi miscibile în condiții obișnuite. De exemplu, în înghețată, ele ajută apa și aerul să formeze o parte din același solid împreună cu grăsimea. Printre cei mai utilizați emulgatori în acest scop se numără cei derivați din acizi grași comestibili.
Detergenți
Caracterul amfifilic al acestor molecule este utilizat pentru a prinde grăsimile sau impuritățile apolare, pentru a fi ulterior transportate în același timp de un solvent polar, cum ar fi apa..
La fel ca exemplul bulelor în care aerul a fost prins, detergenții prind grăsimea în micelele lor, care, având o coajă polară, interacționează eficient cu apa pentru a îndepărta murdăria..
Antioxidanți
Capetele polare au o importanță vitală, deoarece definesc utilizările multiple pe care aceste molecule le pot avea în corp.
Dacă au, de exemplu, un set de inele aromatice (inclusiv derivați ai unui inel fenolic) și inele polare capabile să neutralizeze radicalii liberi, atunci vor exista antioxidanți amfifili; iar dacă le lipsește și efecte toxice, atunci vor exista noi antioxidanți disponibili pe piață.
Referințe
- Alberts B, Johnson A, Lewis J și colab. (2002). Biologia moleculară a celulei. Ediția a IV-a. New York: Garland Science; Stratul bilateral lipidic. Recuperat de la: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Molecule amfifile. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (eds.), Enciclopedia membranelor, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- A spus Iosif. (2019). Definiția moleculelor amfipatice. Studiu. Recuperat de la: study.com
- Lehninger, A. L. (1975). Biochimie. (Ediția a II-a). Worth Publishers, inc.
- Mathews, C. K., van Holde, K. E. și Ahern, K. G. (2002). Biochimie. (Ediția a 3-a). Pearson Addison Weshley.
- Helmenstine, Anne Marie, dr. (31 martie 2019). Ce este un agent tensioactiv? Recuperat de pe: thoughtco.com
- Domenico Lombardo, Mikhail A. Kiselev, Salvatore Magazù și Pietro Calandra (2015). Auto-asamblarea amfifilelor: concepte de bază și perspective viitoare ale abordărilor supramoleculare. Progrese în fizica materiei condensate, vol. 2015, ID articol 151683, 22 pagini, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. & Guo Z. (2018). Un nou grup de molecule amfifile sintetice care conțin fenolici pentru aplicații polivalente: caracterizare fizico-chimică și studiu de toxicitate celulară. Rapoarte științifice volumul 8, numărul articolului: 832.

Nimeni nu a comentat acest articol încă.