
Structura, funcțiile și inhibitorii acetilcolinesterazei
acetilcolinesteraza (acetilcolina acetilhidrolaza, EC 3.1.1.7) este o enzimă care se găsește în principal în sistemul nervos central. Sarcina sa, după cum sugerează și numele, este prelucrarea hidrolitică a neurotransmițătorului acetilcolină..
Este o enzimă asociată cu membrana celulară care funcționează împreună cu receptorul acetilcolinei pentru a media excitația celulelor postsinaptice și al cărei mecanism catalitic este surprinzător de rapid..
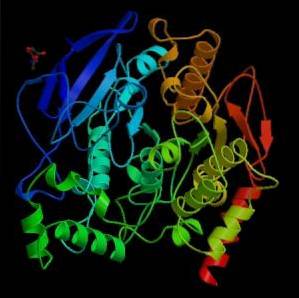
Din punct de vedere mecanic, această enzimă poate fi privită ca o serinhidrolază, iar în domeniul catalitic al situsului său activ conține triada de aminoacizi caracteristică serinelor proteaze: serină, histidină și un reziduu acid. Cu toate acestea, reziduul acid este un glutamat, în timp ce serina proteazele posedă în mod normal un aspartat..
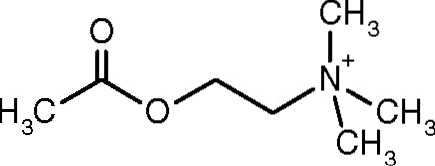
Una dintre primele observații care a legat activitatea catalitică a acetilcolinesterazei cu țesuturile nervoase colinergice și țesuturile musculare a fost făcută de Dale în 1914; ulterior s-a stabilit că este prezent și în neuronii non-colinergici și în celulele hematopoietice, osteogene și neoplazice.
Datorită studiului diferitelor organisme, se știe în prezent că enzima este prezentă în membrana diferitelor tipuri de celule, cum ar fi eritrocitele, celulele nervoase și musculare, organele electrice și altele..
Indice articol
- 1 Structură
- 1.1 Structura terțiară și cuaternară
- 1.2 Structura primară
- 2 Funcții
- 3 inhibitori
- 3.1 Inhibitori ireversibili
- 3.2 Inhibitori reversibili
- 3.3 Butirilcolinesteraza
- 4 Acetilcolinesteraza și boala Alzheimer
- 5 Referințe
Structura
Structura terțiară și cuaternară
În condiții naturale sau „in vivo ", acetilcolinesteraza este o enzimă polimorfă care este compusă din mai multe subunități catalitice de mai mult sau mai puțin 80 kDa, care se asamblează pentru a forma o structură oligomerică (a mai multor subunități).
Cantitatea și complexitatea acestor subunități depind de tipul de celulă și de specia luată în considerare..
Unele dintre formele enzimatice mai complexe au subunități catalitice cu forme globulare (G) sau asimetrice (A) legate prin punți disulfurice. Podurile disulfidice sunt legături covalente formate între două molecule de sulf ale grupărilor tiol (-SH) a două reziduuri ale aminoacidului cisteină.
Fiecare subunitate G conține un singur sit activ, în timp ce subunitățile A sunt în general caracterizate prin faptul că au trei domenii structurale, și anume: subunități catalitice, cozi asemănătoare colagenului bogate în glicină, hidroxiprolină și resturi de hidroxilizină și altele. colagen).
Formele asimetrice ale acetilcolinesterazei sunt cunoscute sub numele de A12, A8 și A4, care au 12, 8 și respectiv 4 subunități catalitice..
În general, reziduurile domeniului catalitic din situl activ se găsesc într-o regiune "profundă" a subunităților, care ar putea fi văzută ca fiind contradictorii în ceea ce privește viteza rapidă a reacției care catalizează această enzimă și inaccesibilitatea aparentă a substratului către aceste site-uri..
Indiferent de polimorfismul enzimei, atât subunitățile globulare, cât și cele asimetrice au activități catalitice similare..
Variante
Unele celule, altele decât celulele nervoase, precum eritrocitele, produc enzime acetilcolinesterazice dimerice predominant globulare, asociate în cea mai mare parte cu fața exterioară a membranei plasmatice..
Enzima eritrocitară, deși are o complexitate structurală mai redusă, este, de asemenea, o enzimă amfipatică, al cărei domeniu catalitic activ se găsește în regiunea hidrofilă mare, în timp ce domeniul hidrofob, care conține regiunea terminală carboxil, este responsabil pentru susținerea acesteia în membrană..
Structura primară
O mare parte din cunoștințele actuale despre secvența acetilcolinesterazei au apărut din studiul enzimei Torpila Californica, un pește stingray care trăiește în Oceanul Pacific și a fost folosit în mod tradițional ca organism model pentru studiul diferitelor proteine ale sistemului nervos.
Subunitățile de acetilcolinesterază sunt sintetizate ca pro-proteine care sunt apoi procesate pentru a da naștere la subunități mature. Fiecare subunitate constă dintr-o polipeptidă de aproximativ 575 aminoacizi și 65 kDa în greutate moleculară, care este crescută prin adăugarea de 7-8% resturi de carbohidrați (glicozilare)..
Activitatea catalitică a sitului activ al subunităților este determinată de un reziduu de serină la poziția 200, care se găsește într-o regiune "profundă" a subunităților catalitice..
Diferite variante sau izoforme ale enzimei există în organisme datorită siturilor diferite pentru „splicing alternativ " ale ARN-urilor pre-mesager la ambele capete (5 'și 3'). Secvența carboxil-terminală a izoformei fiecărei subunități este cea care determină asamblarea oligomerilor între ei..
Caracteristici
Acetilcolinesteraza este o enzimă cu funcții biologice multiple care nu sunt neapărat legate între ele. Fapt atestat de expresia diferențială a acestuia în timpul embriogenezei, extensiei neuronale embrionare, dezvoltării musculare și sinaptogenezei.
După cum sa evidențiat mai sus, are un rol important în hidroliza rapidă a acetilcolinei și, prin urmare, în reglarea efectului acesteia în spațiul sinaptic neuromuscular sau în spațiile sinaptice colinergice ale sistemului nervos central..
Un exemplu al funcțiilor sale este contracția mușchiului scheletic, care apare datorită unui tip de sinapsă chimică cunoscută sub numele de placă motoră, situată între un neuron motor și o fibră musculară..
La această sinapsă se realizează sute de vezicule încărcate cu acetilcolină, care sunt eliberate din neuronul motor pentru propagarea unui impuls electric..
Acest proces de neurotransmisie este destul de complex, cu toate acestea, participarea acetilcolinesterazei este crucială pentru terminarea transmisiei sinaptice care depinde de neurotransmițătorul acetilcolină, deoarece trebuie să fie degradată și apoi trebuie să difuzeze în afara fantei sinaptice pentru a culmina cu excitația membranei..
Astfel, enzima acetilcolinesterază este responsabilă de reglarea concentrației acestui transmițător în sinapsă neuromotorie..
Alte funcții "non-clasice" ale enzimei sunt legate de neuritogeneză sau de creșterea celulelor nervoase; cu procesele de adeziune celulară, sinaptogeneza, activarea neuronilor-dopamină în substanța neagră a creierului mediu, procesele hematopoietice și trombul poietic, printre altele.
Inhibitori
Inhibitorii de acetilcolinesterază acționează prevenind hidrolizarea acetilcolinei, crescând astfel nivelul și durata de acțiune a acestui neurotransmițător. Pot fi clasificate, în funcție de mecanismul lor de acțiune, ca reversibile și ireversibile.
Inhibitori ireversibili
Acestea sunt cele care inhibă ireversibil activitatea hidrolitică a acetilcolinesterazei prin legarea sa covalentă la reziduul de serină din situl activ al enzimei. Acest grup este compus în principal din organofosfați.
În general, aceștia sunt compuși activi prezenți în multe insecticide și sunt responsabili pentru un număr mare de decese otrăvitoare accidentale. Sunt esteri sau tioli derivați din acid fosforic, fosfonic, fosfinic sau fosforamidic.
Sarin, tabun, soman și ciclosarină sunt printre cei mai toxici compuși sintetizați de om, deoarece pot ucide o ființă umană prin inducerea insuficienței respiratorii și circulatorii prin blocarea acetilcolinesterazei în sistemul nervos periferic..
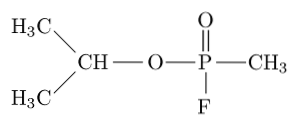
Sarin, de exemplu, este un „gaz nervos” care a fost folosit ca armă chimică pentru uz terorist..
Inhibitori reversibili
Această ordine de clasificare grupează inhibitori competitivi și necompetitivi care funcționează prin carbamilare tranzitorie și reversibilă a unui reziduu de serină în situsul activ și mulți au fost sintetizați și purificați din surse vegetale sau fungice..
Carbamații precum fizostigmina și neostigmina sunt inhibitori reversibili care sunt folosiți ca medicamente pentru tratamentul bolilor precum glaucomul și, respectiv, miastenia gravis..
Alți agenți terapeutici din acest grup sunt utilizați, de asemenea, pentru tratamentul bolii Alzheimer, a bolii Parkinson, a obstrucțiilor intestinale postoperatorii (ileus postoperator), a distensiei vezicii urinare și ca antidoturi pentru supradozajul anticolinergic..
Butirilcolinesteraza
Un mecanism natural interesant împotriva unor substanțe inhibitoare ale acetilcolinesterazei are legătură cu participarea unei enzime mai puțin specifice cunoscute sub numele de butirilcolinesterază.
Această enzimă este, de asemenea, capabilă să hidrolizeze acetilcolina și, în același timp, poate acționa ca un momeal molecular care reacționează cu aceste toxine înainte de a-și exercita efectul negativ asupra acetilcolinesterazei..
Acetilcolinesteraza și boala Alzheimer
S-a demonstrat că acetilcolinesteraza formează un complex stabil cu componentele plăcilor senile caracteristice patologiei. Mai mult, unele modele de glicozilare modificate ale acestei enzime au fost legate de prezența și formarea plăcilor amiloide în creier..
Mulți dintre inhibitorii reversibili ai acetilcolinesterazei, prin urmare, au fost utilizați ca medicamente de primă generație pentru tratamentul acestei boli și a altor afecțiuni neurodegenerative conexe. Acestea includ donepezil, rivastigmină și galantamină..
Referințe
- Dvir, H., Silman, I., Harel, M., Rosenberry, T. L. și Sussman, J. L. (2010). Acetilcolinesterază: De la structura 3D la funcție. Interacțiuni chimico-biologice, 187, 10-22.
- Houghton, P., Ren, Y. și Howes, M. (2006). Inhibitori ai acetilcolinesterazei din plante și ciuperci. Rapoarte despre produse naturale, 2. 3, 181-199.
- Krsti, D. Z., Lazarevi, T. D., Bond, A. M. și Vasi, V. M. (2013). Inhibitori ai acetilcolinesterazei: farmacologie și toxicologie. Neurofarmacologie actuală, unsprezece, 315-335.
- Mukherjee, P. K., Kumar, V., Mal, M. și Houghton, P. J. (2007). Inhibitori ai acetilcolinesterazei din plante. Fitomedicina, 14, 289-300.
- Quinn, D. M. (1987). Acetilcolinesterază: structură enzimatică, dinamică de reacție și stări de tranziție virtuală. Chem. Rev.., 87, 955-979.
- Racchi, M., Mazzucchelli, M., Porrello, E., Lanni, C. și Govoni, S. (2004). Inhibitori ai acetilcolinesterazei: activități noi ale moleculelor vechi. Cercetări farmacologice, cincizeci, 441-451.
- Rosenberry, T. (1975). Acetilcolinesteraza. Progrese în enzimologie și domenii conexe ale biologiei moleculare, 43, 103-218.
- Soreq, H. și Seidman, S. (2001). Acetilcolinesteraza - roluri noi pentru un actor vechi. Nature Reviews, Două, 294-302.
- Talesa, V. N. (2001). Acetilcolinesteraza în boala Alzheimer. Mecanisme de îmbătrânire și dezvoltare, 122, 1961-1969.



Nimeni nu a comentat acest articol încă.