
LIA Agar (Lysine Iron) fundal, preparare și utilizări
Agar LIA (Lisina de fier) este un test biochimic utilizat pentru identificarea bacteriilor din familia Enterobacteriaceae. Acest mediu a fost creat de Edwards și Fife, pe baza formulei Falkow.
Inițial, acest test a fost un bulion care conțin peptone, extract de drojdie, glucoză, L-lizină, purpuriu de bromocrezol și apă distilată. Edwards și Fife au adăugat agar-agar, citrat feric de amoniu și tiosulfat de sodiu..
Testul constă practic în demonstrarea prezenței enzimei lizină decarboxilază, capabilă să reacționeze cu gruparea carboxil a aminoacidului L-lizină. O dezaminare a aminoacidului poate apărea și din cauza prezenței enzimei lizin deaminază..
În plus, compoziția mediului permite dovezi ale capacității unor genuri bacteriene de a produce hidrogen sulfurat. În cele din urmă, este de asemenea posibil să se observe generarea sau nu de gaz în mediu.
Indice articol
- 1 Justificare
- 1.1 Pepton și extract de drojdie
- 1.2 Glucoza
- 1.3 L-lizină
- Indicator pH 1,4 (violet bromocrezol)
- 1,5 Citrat de amoniu feric și tiosulfat de sodiu
- 2 Interpretarea testului
- 2.1 Decarboxilarea lizinei
- 2.2 Deaminarea lizinei
- 2.3 Producerea hidrogenului sulfurat (H2S)
- 3 Înregistrarea rezultatelor
- 4 Pregătirea
- 5 utilizări
- 6 Referințe
Bază
Pepton și extract de drojdie
La fel ca majoritatea mediilor de cultură, agarul cu fier de lizină conține componente care furnizează sursa de nutrienți necesari creșterii bacteriilor. Aceste componente sunt reprezentate de pepton și extract de drojdie.
Glucoză
La fel, acest agar conține glucoză ca un carbohidrat fermentabil. Se știe că toate bacteriile din familia Enterobacteriaceae fermentează glucoza.
Acest pas este crucial, deoarece va fi responsabil pentru acidificarea mediului, o condiție esențială pentru enzima lizină decarboxilază - dacă este prezentă - să acționeze asupra substratului său..
În unele genuri bacteriene, se poate observa producția de gaze datorită fermentării glucozei.
Gazul este evidențiat atunci când există o deplasare a agarului în tub, lăsând un spațiu gol în partea de jos a tubului sau prin fractura mediului în două sau mai multe porțiuni.
L-lizină
Odată ce lizina este decarboxilată, se formează o diamină (cadaverină) și dioxid de carbon.
Decarboxilarea are loc în prezența coenzimei piridoxal fosfat. Această reacție este ireversibilă.
Indicator PH (violet bromocrezol)
Toate modificările de pH care apar în mediu datorită diverselor reacții sunt detectate de indicatorul pH-ului bromocrezol purpuriu..
În acest sens, atunci când există acidificare, mediul devine galben, iar atunci când există alcalinizare, mediul revine la culoarea originală purpurie sau violet..
Când are loc dezaminarea lizinei datorită prezenței enzimei lizină deaminază, la suprafață se formează o culoare roșiatică, tipică în genurile Proteus, Providencia și unele specii de Morganella.
Acest lucru se datorează faptului că acidul alfa-ceto-carbonic se formează în timpul procesului de dezaminare, care reacționează cu citrat de amoniu în prezența oxigenului, provocând culoarea menționată mai sus..
Citrat feric de amoniu și tiosulfat de sodiu
Pe de altă parte, bacteriile care produc hidrogen sulfurat vor fi evidențiate de prezența tiosulfatului de sodiu (sursă de sulf) și citratului feric de amoniu, care este dezvoltatorul HDouăS.
Bacteriile care posedă enzima tiosulfat reductază au capacitatea de a acționa prin reducerea tiosulfatului de sodiu prezent, formând sulfit și hidrogen sulfurat (HDouăS).
Acesta din urmă este un gaz incolor, dar când reacționează cu sarea de fier formează sulfură metalică feroasă, care este un compus insolubil (precipitat negru vizibil).
Cu toate acestea, capacitatea de formare a lui HDouăS cu acest mediu nu este foarte fiabil, deoarece unele bacterii lizină decarboxilază negative capabile să producă HDouăS nu va forma precipitatul negru, deoarece aciditatea mediului interferează. De aceea, se recomandă verificarea cu alte medii care conțin fier.
Interpretarea testului
Decarboxilarea lizinei
Tuburile trebuie citite după cele 24 de ore de incubare, altfel există riscul de a interpreta greșit reacția, raportând negative negative.
Trebuie amintit că prima reacție care va avea loc va fi fermentarea glucozei, prin urmare toate tuburile după 10 până la 12 ore vor deveni galbene..
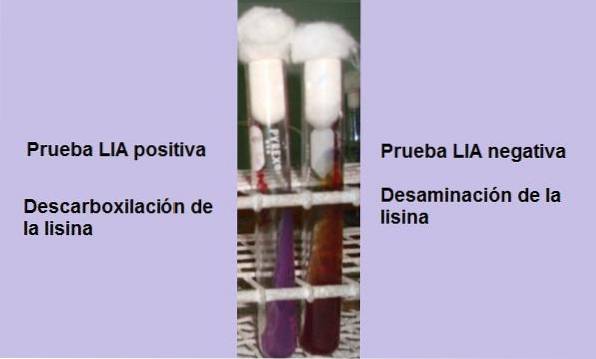
Dacă la sfârșitul timpului de incubație (24 de ore) se observă un fundal galben cu o suprafață purpurie sau purpurie, reacția este negativă. Culoarea violet a suprafeței corespunde alcalinizării mediului prin utilizarea peptonelor.
O reacție pozitivă este aceea în care fundul și suprafața tubului sunt complet violet, adică revine la culoarea originală..
Prin urmare, cine determină pozitivitatea testului este baza sau fundalul mediului. Dacă aveți dubii despre culoare, aceasta poate fi comparată cu un tub LIA neinoculat.
Deaminarea lizinei
Un tub care prezintă dezaminarea lizinei va avea o suprafață maronie roșiatică și un fundal galben (acid), sau întregul tub va avea o culoare maronie roșiatică..
Această reacție este interpretată ca fiind negativă pentru decarboxilarea lizinei, dar pozitivă pentru dezaminarea lizinei..
Această reacție este definită și interpretată pe cadru.
Producerea de sulfură de hidrogen (HDouăS)
O reacție pozitivă se observă prin apariția unui precipitat negru în tot sau în parte a mediului. De obicei între marginea teșitului și baza.
Dacă precipitatul apare în tot tubul, acesta nu va arăta celelalte reacții care apar în mijloc..
Înregistrarea rezultatelor
La interpretarea testului, rezultatele sunt înregistrate după cum urmează:
Rama este citită mai întâi, apoi partea de jos sau blocul, apoi producția de HDouăDa, și în cele din urmă producția de gaz.
Exemplu: K / A + (-). Asta înseamnă:
- K: cadran alcalin (culoare violet)
- A: Fundal acid (galben), adică reacție de decarboxilare negativă și dezaminare negativă.
- +: Producția de hidrogen sulfurat
- (-): Fără gaz.
Pregătirea
Se cântăresc 35 g de mediu de lizină agar fier deshidratat și se dizolvă într-un litru de apă distilată..
Se încălzește până când agarul se dizolvă complet, pentru a face acest lucru lăsați-l să fiarbă un minut, amestecând frecvent. Distribuiți 4 ml de mediu în eprubete 13/100 cu capace de bumbac.
Sterilizați într-o autoclavă la 121 ° C timp de 15 minute. Scoateți-l din autoclavă și lăsați-l să stea într-un unghi, astfel încât să existe o bază adâncă și o conică scurtă.
A se păstra la frigider la 2-8 ° C. Se lasă să se încălzească înainte de a semăna tulpina bacteriană.
Mediul deshidratat este bej, iar mediul preparat este violet roșiatic..
PH-ul final al mediului preparat este de 6,7 ± 0,2
Mediul devine galben cu pH egal sau mai mic de 5,2 și este purpuriu la pH 6,5 și mai mare.
Aplicații
Acest test, împreună cu alte teste biochimice, este utilizat pentru a identifica bacilii din familia Enterobacteriaceae..
Mediul este însămânțat cu o buclă dreaptă sau ac, una sau două puncții sunt făcute în partea de jos a tubului, iar apoi suprafața mediului este marcată în zig-zag..
Se incubează 24 de ore la 35-37 ° C în aerobioză. Dacă este necesar, incubați încă 24 de ore..
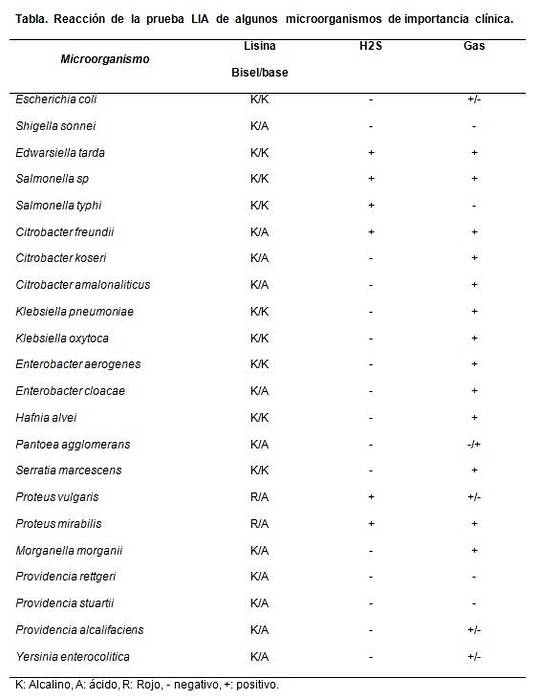
Este util în principal pentru a diferenția speciile de Citrobacter lactoză negativă de Salmonellas sp.
Referințe
- Mac Faddin J. (2003). Teste biochimice pentru identificarea bacteriilor de importanță clinică. Ed. A 3-a Editorial Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosticul microbiologic Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosticul microbiologic. A 5-a ed. Editorial Panamericana S.A. Argentina.
- Laboratoarele Britannia. Agar de fier lizinic. 2015. Disponibil la: britanialab.com
- Laboratoarele BD. BBL Lisină Fier Agar Slants. 2007. Disponibil la: bd.com
- Laboratoarele Valtek. Mijlociu L.I.A. 2009. Disponibil la: andinamedica.com



Nimeni nu a comentat acest articol încă.