
Structura alcoolului isoamilic, proprietăți, utilizări și riscuri
alcool izoamilic este un compus organic a cărui formulă este (CH3)DouăCHCHDouăCHDouăOH. Din punct de vedere chimic, este un alcool primar ramificat și constituie unul dintre izomerii pentanolului, numiți alcooli amilici (C5H12SAU).
La fel ca mulți alcooli cu greutate moleculară mică, este un lichid incolor la temperatura camerei. Acest lucru permite și facilitează utilizarea acestuia ca solvent pentru diferite aplicații; cu atât mai mult, când nu exercită prea multe efecte negative asupra ecosistemului după ce a fost eliminată.
Deși este un material intermediar în sinteza acetatului de amil pentru producerea parfumurilor artificiale de banane, propriul miros este neplăcut și similar cu cel al perei..
Pe lângă faptul că servește ca solvent pentru mai multe substanțe biologice și ca intermediar în sinteza altor acetați, reduce tensiunea superficială a anumitor formulări industriale, prevenind formarea de spume. Prin urmare, este utilizat în sistemele microemulsificate.
În ceea ce privește originea sa naturală, alcoolul izoamilic a fost găsit în feromonii viespilor și în trufele negre, un tip de ciuperci situate în sud-estul Europei.
Indice articol
- 1 Structura alcoolului izoamilic
- 1.1 Interacțiuni intermoleculare
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Miros și gust
- 2.3 Masa molară
- 2.4 Densitatea
- 2.5 Densitatea vaporilor
- 2.6 Presiunea vaporilor
- 2.7 Punctul de fierbere
- 2.8 Punct de topire
- 2.9 Punct de aprindere
- 2.10 Temperatura de autoinflamare
- 2.11 Solubilitate
- 2.12 Vâscozitatea
- 2.13 Tensiunea superficială
- 2.14 Indicele de refracție
- 2.15 Capacitate termică
- 3 utilizări
- 3.1 Materie primă
- 3.2 Parfumuri
- 3.3 Antispumant
- 3.4 Extracții
- 4 Riscuri
- 4.1 Depozitare și reactivitate
- 4.2 Sănătate
- 5 Referințe
Structura alcoolului izoamilic
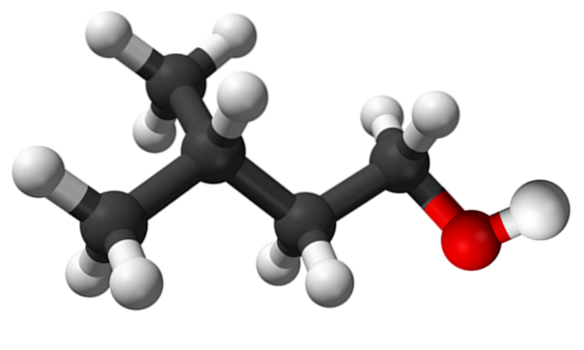
Imaginea superioară arată molecula de alcool izoamilic reprezentată cu un model de sfere și bare. În dreapta acesteia, sfera roșiatică corespunde atomului de oxigen al grupei OH, caracteristic tuturor alcoolilor; în timp ce în stânga este scheletul de carbon cu o grupare metil, CH3, structură de ramificare.
Din punct de vedere molecular, acest compus este dinamic deoarece are atomi cu hibridizări sp3, facilitarea rotației linkurilor dvs.; atâta timp cât nu provoacă eclipsarea OH și CH3.
De asemenea, merită menționat caracteristica sa amfiphilică: are un capăt apolar sau hidrofob, alcătuit din lanț (CH3)DouăCHCHDouăCHDouă-, și un cap polar sau hidrofil, grupul OH. Această definiție a două zone specifice de polarități diferite face din acest alcool un agent tensioactiv; și, prin urmare, aplicarea sa pentru microemulsii.
Interacțiuni intermoleculare
Având în vedere prezența grupului OH, molecula de alcool izoamilic prezintă un moment dipol permanent. În consecință, forțele dipol-dipol reușesc să își lege moleculele, responsabile de proprietățile fizice și măsurabile ale lichidului, precum și de mirosul acestuia..
Deși ramificarea lanțurilor principale scade interacțiunile efective dintre molecule, legăturile de hidrogen din acest alcool compensează această scădere, provocând fierberea lichidului la 131 ° C, o temperatură peste punctul de fierbere al apei..
Nu același lucru se întâmplă cu solidul sau "gheața", care se topește la -117 ° C, indicând faptul că interacțiunile sale intermoleculare nu sunt suficient de puternice pentru a-și menține moleculele în ordine; mai ales dacă grupul CH3 care ramifică lanțul principal împiedică un contact mai bun între molecule.
Proprietăți
Aspectul fizic
Lichid incolor.
Miros și gust
Dă un miros neplăcut de pară și are un gust înțepător.
Masă molară
88,148 g / mol.
Densitate
0,8104 g / ml la 20 ° C. Prin urmare, este mai puțin dens decât apa.
Densitatea vaporilor
Este de 3,04 ori mai dens decât aerul.
Presiunea de vapori
2,37 mmHg la 25 ° C.
Punct de fierbere
131,1 ° C.
Punct de topire
-117,2 ° C.
punctul de aprindere
43 ° C (cupă închisă).
temperatură de autoaprindere
340 ° C.
Solubilitate
Este relativ solubil în apă: 28g / L. Acest lucru se datorează faptului că moleculele extrem de polare din apă nu au o afinitate specială pentru lanțul de carbon al alcoolului izoamilic. Dacă ar fi amestecate, s-ar observa două faze: una inferioară, corespunzătoare apei și una superioară, cea a alcoolului izoamilic..
În schimb, este mult mai solubil în solvenți mai puțin polari, cum ar fi: acetonă, dietil eter, cloroform, etanol sau acid acetic glacial; și chiar în eter de petrol.
Viscozitate
3.738 cP la 25 ° C.
Tensiune de suprafata
24,77 dyne / cm la 15 ° C.
Indicele de refracție
1,4075 la 20 ° C.
Capacitate de căldură
2,382 kJ / gK.
Aplicații
Materii prime
Alți esteri, tiofen și medicamente precum nitritul de amil, Validol (izovalerat de mentil), Bromisoval (bromovalerilurea), Corvalol (un tranchilizant valerianic) și Barbamil (amobarbital) pot fi sintetizate din alcool izoamilic..
Parfumuri
Pe lângă faptul că este utilizat pentru sinteza acetatului de amil, care are o aromă de banane, din acesta se obțin și alte parfumuri de fructe precum caise, portocale, prune, cireșe și malț. Prin urmare, este un alcool necesar în producția multor produse comestibile sau cosmetice..
Antispumant
Reducând tensiunea superficială, promovează utilizarea sa în sistemele microemulsificate. Practic, evită formarea accelerată a bulelor, reducându-le ca dimensiune până se rup.
De asemenea, ajută la definirea mai bună a interfeței dintre fazele apoase și organice în timpul extracțiilor; de exemplu, fenol-cloroform este adăugat la amestecul extractor într-un raport de 25: 24: 1. Această tehnică este destinată extracției ADN-ului.
Extracții
Alcoolul isoamilic face posibilă extragerea grăsimilor sau uleiurilor din diferite probe, de exemplu din lapte. În mod similar, dizolvă ceară de parafină, cerneluri, gume, lacuri și esteri de celuloză.
Continuând cu extracțiile, este posibil să se obțină acid fosforic din soluții de nitrați ai mineralelor fosfat de fier..
Riscuri
Depozitare și reactivitate
Ca orice lichid care degajă mirosuri, poate reprezenta un risc iminent de incendiu dacă locul în care este depozitat își ridică temperatura prea ridicată, chiar mai mult dacă există deja o sursă de căldură.
În aceste condiții, acționează pur și simplu ca un combustibil, alimentând flăcările și chiar explodând containerul său. Când arde, eliberează vapori care pot afecta sănătatea și pot sufoca.
Alte cauze care iau foc alcoolul izoamilic este amestecarea acestuia sau reacționarea acestuia cu substanțe precum: perclorați, peroxizi, brom, fluor, hidruri metalice, acizi puternici, amine alifatice etc..
Sănătate
În contact cu pielea, aceasta o poate irita și usca. Cu toate acestea, simptomele sunt mai severe dacă sunt inhalate prea mult timp (tuse, arsuri la nivelul nasului, gâtului și plămânilor) sau dacă sunt înghițite (cefalee, greață, diaree, vărsături, amețeli și pierderea cunoștinței).
Și, în cele din urmă, când se varsă în ochi, îi irită și îi poate deteriora chiar ireversibil. Din fericire, mirosul său de „pere alcoolice” îi permite să fie detectat în cazul unei scurgeri sau scurgeri; în plus, este un compus care trebuie tratat cu respect.
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Wikipedia. (2019). Alcoolul isoamilic. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Alcoolul isoamilic. Baza de date PubChem. CID = 31260. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Zhang Yu și Muhammed Mamoun. (17 septembrie 2008). Extracția acidului fosforic din soluțiile de nitrați cu alcool izoamilic. Solvent Extraction and Ion Exchange Volume 6, 1988 - Ediția 6. doi.org/10.1080/07366298808917973
- Departamentul de Sănătate din New Jersey. (2008). Alcoolul isoamilic. [PDF]. Recuperat de la: nj.gov
- Kat Chem. (2019). Alcoolul isoamilic. Recuperat de la: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Alcoolul isoamilic. Recuperat de pe: chemoxy.com



Nimeni nu a comentat acest articol încă.