
Structura alcoolică primară, proprietăți, nomenclatură, exemple
A alcool primar este una în care gruparea hidroxil este atașată la un carbon primar; adică un carbon legat covalent de un alt carbon și hidrogeni. Formula sa generală este ROH, în special RCHDouăOH, deoarece există o singură grupare alchil R.
Grupul R cu formula RCHDouăOH poate fi oricare: un lanț, un inel sau heteroatomi. Când vine vorba de un lanț, scurt sau lung, avem de-a face cu cei mai reprezentativi alcooli primari; printre acestea se numără metanolul și etanolul, două dintre cele mai sintetizate la nivel industrial.

Fizic sunt ca alți alcooli, iar punctele lor de fierbere sau de topire depind de gradul de ramificare; dar din punct de vedere chimic, acestea sunt cele mai reactive. În plus, aciditatea sa este mai mare decât cea a alcoolilor secundari și terțiari.
Alcoolii primari suferă reacții de oxidare, devenind un număr mare de compuși organici: esteri și eteri, aldehide și acizi carboxilici. La fel, pot suferi reacții de deshidratare, transformându-se în alchene sau olefine.
Indice articol
- 1 Structura unui alcool primar
- 2 Proprietăți
- 2.1 Aciditate
- 2.2 Reacții chimice
- 3 Nomenclatură
- 4 Exemple
- 5 Referințe
Structura unui alcool primar
Alcoolii primari derivați din alcani liniari sunt cei mai reprezentativi. Cu toate acestea, în realitate, orice structură, liniară sau ramificată, poate fi clasificată în acest tip de alcooli, atâta timp cât grupul OH este legat de un CHDouă.
Deci, structural, toate au în comun prezența grupului -CHDouăOH, numit metilol. O caracteristică și o consecință a acestui fapt este că grupul OH este mai puțin împiedicat; adică poate interacționa cu mediul fără interferențe spațiale de la alți atomi.
La fel, un OH mai puțin împiedicat înseamnă că atomul de carbon care îl poartă, cel al CHDouă, poate suferi reacții de substituție printr-un mecanism SNDouă (bimolecular, fără formarea unei carbocații).
Pe de altă parte, un OH cu o mai mare libertate de a interacționa cu mediul se traduce prin interacțiuni intermoleculare mai puternice (prin legături de hidrogen), care la rândul lor măresc punctele de topire sau fierbere.
La fel se întâmplă cu solubilitatea sa în solvenți polari, atâta timp cât grupul R nu este foarte hidrofob..
Proprietăți
Aciditate
Alcoolii primari sunt dintre cei mai acizi. Pentru ca un alcool să se comporte ca un acid Bronsted, trebuie să donezi un ion H+ la mediu, pentru a spune apă, pentru a deveni un anion alcoxid:
ROH + HDouăSAU <=> RO- + H3SAU+
Sarcina negativă a RO-, în mod specific de la RCHDouăSAU-, este mai puțin respinsă de electronii din cele două legături C-H decât de electronii din legătura C-R.
Gruparea alchil exercită apoi cea mai mare respingere, destabilizând RCHDouăSAU-; dar nu atât de mult în comparație cu asta dacă ar exista două sau trei grupe R, ca și în cazul alcoolilor secundari și terțiari, respectiv.
O altă modalitate de a explica aciditatea mai mare a unui alcool primar este prin diferența de electronegativitate, creând momentul dipol: HDouăCδ+-SAUδ-H. Oxigenul atrage densitatea electronilor din ambele CHDouă ca de la H; sarcina parțială pozitivă a carbonului respinge puțin cea a hidrogenului.
Grupul R transferă o parte din densitatea sa de electroni către CHDouă, ceea ce ajută la scăderea încărcării sale parțiale pozitive și, odată cu aceasta, repulsia sa pentru sarcina de hidrogen. Cu cât există mai multe grupuri R, cu atât este mai mică repulsia și, prin urmare, tendința lui H de a fi eliberată ca H+.
pKa
Alcoolii primari sunt considerați acizi mai slabi decât apa, cu excepția alcoolului metilic, care este puțin mai puternic. PKa alcoolului metilic este 15,2; iar pKa alcoolului etilic este 16,0. Între timp, pKa de apă este de 15,7.
Cu toate acestea, apa, care este considerată un acid slab, ca și alcoolii, se poate lega de H+ să se transforme în ionul hidroniu, H3SAU+; adică se comportă ca bază.
În același mod, alcoolii primari pot absorbi hidrogen; mai ales în unele dintre propriile sale reacții, de exemplu, în transformarea sa în alchene sau olefine.
Reacții chimice
Formarea halogenurilor de alchil
Alcoolii reacționează cu halogenuri de hidrogen pentru a produce halogenuri de alchil. Reactivitatea alcoolilor față de halogenurile de hidrogen scade în următoarea ordine:
Alcool terțiar> alcool secundar> alcool primar
ROH + HX => RX + HDouăSAU
RX este o halogenură de alchil primară (CH3Cl, CH3CHDouăBr, etc.).
O altă modalitate de preparare a halogenurilor de alchil este prin reacția clorurii de tionil, un reactiv sintetic, cu un alcool primar care este transformat într-o clorură de alchil. Clorura de tionil (SOClDouă) necesită prezența piridinei pentru a reacționa.
CH3(CHDouă)3CHDouăOH + SOClDouă => CH3(CHDouă)3CHDouăCl + SODouă + acid clorhidric
Această reacție corespunde halogenării 1-pentanolului pentru a deveni 1-cloropentan în prezența piridinei.
Oxidarea alcoolilor primari
Alcoolii pot fi oxidați în aldehide și acizi carboxilici, în funcție de reactiv. Clorocromatul de piridiniu (PCC) oxidează alcoolul primar în aldehidă, folosind diclormetan (CHDouăClDouă):
CH3(CHDouă)5CHDouăOH => CH3(CHDouă)5COH
Aceasta este oxidarea 1-heptanolului la 1-heptanal.
Între timp, permanganatul de potasiu (KMnO4) oxidează mai întâi alcoolul în aldehidă, iar apoi oxidează aldehida în acid carboxilic. Când permanganatul de potasiu este utilizat pentru oxidarea alcoolilor, trebuie evitată ruperea legăturii dintre carbonii 3 și 4..
CH3(CHDouă)4CHDouăOH => CH3(CHDouă)4COOH
Aceasta este oxidarea 1-hexanolului în acid hexanoic.
Prin această metodă este dificil să se obțină o aldehidă, deoarece este ușor oxidată până la acid carboxilic. O situație similară se observă atunci când acidul crom este utilizat pentru oxidarea alcoolilor.
Formarea eterilor
Alcoolii primari pot fi transformați în eteri atunci când sunt încălziți în prezența unui catalizator, de obicei acid sulfuric:
2 RCHDouăOH => RCHDouăOCHDouăR + HDouăSAU
Formarea esterilor organici
Condensarea unui alcool și a unui acid carboxilic, esterificarea lui Fisher, catalizată de un acid, produce un ester și apă:
R'OH + RCOOH <=> RCOOR '+ HDouăSAU
O reacție bine cunoscută este cea a etanolului cu acid acetic, pentru a da acetat de etil:
CH3CHDouăOH + CH3COOH <=> CH3COOHCHDouăCH3 + HDouăSAU
Alcoolul primar este cel mai susceptibil la reacțiile de esterificare Fischer.
Deshidratare
La temperaturi ridicate și într-un mediu acid, în general acid sulfuric, alcoolii se deshidratează pentru a forma alchene cu pierderea unei molecule de apă.
CH3CHDouăOH => HDouăC = CHDouă + HDouăSAU
Aceasta este reacția de deshidratare a etanolului la etilenă. O formulă generală mai adecvată pentru acest tip de reacție, în special pentru un alcool primar, ar fi:
RCHDouăOH => R = CHDouă (care este, de asemenea, egal cu RC = CHDouă)
Nomenclatură
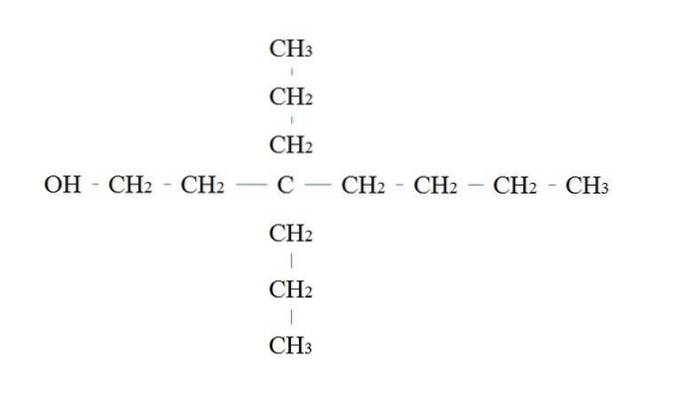
Regulile pentru numirea unui alcool primar sunt aceleași ca și pentru ceilalți alcooli; cu excepția faptului că uneori nu este necesar să se enumere carbonul purtător de OH.
În imaginea superioară există un lanț principal cu șapte carbon. Carbonului legat de OH i se atribuie numărul 1 și apoi începe să fie numărat de la stânga la dreapta. Prin urmare, denumirea sa IUPAC este: 3,3-dietilheptanol.
Rețineți că acesta este un exemplu de alcool primar foarte ramificat.
Exemple
În cele din urmă, unii alcooli primari sunt menționați pe baza nomenclaturii lor tradiționale și sistematice:
-Metil, CH3Oh
-Etil, CH3CHDouăOh
-n-propil, CH3CHDouăCHDouăOh
-n-hexil, CH3CHDouăCHDouăCHDouăCHDouăCHDouăOh
Acestea sunt derivați ai alcanilor liniari. Alte exemple sunt:
-2-feniletanol, C6H5CHDouăCHDouăOH (C6H5 = inel benzenic)
-2-propen-1-ol (alcool alilic), CHDouă= CHCHDouăOh
-1,2-etandiol, CHDouăOHCHDouăOh
-2-cloroetanol (etileneclorhidrină), ClCHDouăCHDouăOh
-2-buten-1-ol (alcool crotilic), CH3CH = CHCHDouăOh
Referințe
- Morrison, R.T. și Boyd, R. N. (1987). Chimie organica. (5ta Ediție). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Chimie organica. (6ta Ediție). McGraw-Hill, Interamerica, Editores S.A.
- Știința Mel. (2019). Cum are loc oxidarea alcoolilor primari. Recuperat de pe: melscience.com
- Societatea Regală de Chimie. (2019). Definiție: alcooli primari. Recuperat de pe: rsc.org
- Chriss E. McDonald. (2000). Oxidarea alcoolilor primari la esteri: trei experimente de investigație conexe. J. Chem. Educ., 2000, 77 (6), p 750. DOI: 10.1021 / ed077p750



Nimeni nu a comentat acest articol încă.