
Caracteristici, tipuri, funcții, studii ale autofagiei

autofagie este un sistem de degradare intracelular care apare într-o manieră conservată în lizozomii tuturor celulelor eucariote (și vacuolii drojdiei). Cuvântul este folosit în general pentru a se referi la degradarea componentelor citosolului sau a „părților” celulei care sunt „învechite” sau care au încetat să funcționeze corect..
Termenul de autofagie a fost inventat în 1963 la Universitatea Rockefeller de De Duve, care a observat și a descris și procesele de endocitoză celulară. Literal, cuvântul autofagie înseamnă „a te consuma”, deși unii autori îl descriu ca un „canibalism de sine”.
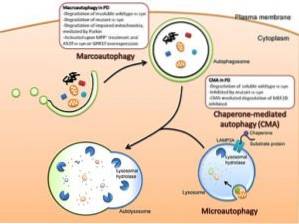
Acest sistem diferă de degradarea mediată de proteazom prin faptul că autofagia este capabilă să îndepărteze organite intracelulare complete și complexe proteice mari sau agregate într-un mod neselectiv..
În ciuda acestei fagocitoze neselective, diferite investigații au arătat că autofagia are numeroase implicații fiziologice și patologice. Deoarece este activat în perioadele de adaptare la foamete, în timpul dezvoltării, pentru eliminarea microorganismelor invadatoare, în timpul morții celulare programate, pentru eliminarea tumorilor, prezentarea antigenelor etc..
Indice articol
- 1 Caracteristici
- 1.1 Inducerea autofagiei
- 2 tipuri
- 2.1 Macroautofagie
- 2.2 Microautofagie
- 2.3 Autofagie mediată de chaperonă
- 3 Funcții
- 3.1 Roluri în sănătate și dezvoltare
- 4 Studii Yoshinori Ohsumi
- 5 Referințe
Caracteristici
Autofagia, după cum sa discutat, este un proces mediat de un organet citoplasmatic cunoscut sub numele de lizozom..
Procesul „autofagiei” începe cu încapsularea organitei care va fi degradată de o membrană dublă, formând un corp membranos cunoscut sub numele de autofagozom. Membrana autofagozomă fuzionează ulterior cu membrana lizozomală sau cu un endosom târziu.
Fiecare dintre acești pași între sechestrarea, degradarea și eliberarea aminoacizilor sau a altor componente pentru reciclare exercită funcții diferite în contexte celulare diferite, făcând din autofagie un sistem extrem de multifuncțional..
Autofagia este un proces destul de controlat, deoarece doar componentele celulare marcate sunt direcționate către această cale de degradare și marcarea are loc în general în timpul proceselor de remodelare celulară..
De exemplu, atunci când o celulă hepatică stabilește un răspuns de detoxifiere ca răspuns la medicamente solubile în grăsimi, reticulul său endoplasmic neted proliferează considerabil, iar atunci când stimulul generat de medicament scade, reticulul endoplasmic neted în exces este eliminat din spațiul citosolic prin autofagie..
Inducerea autofagiei
Unul dintre evenimentele care declanșează cel mai frecvent procesele autofagice este foamea..
În funcție de organismul luat în considerare, diferite tipuri de nutrienți esențiali pot declanșa acest sistem de „reciclare”. La drojdii, de exemplu, deși lipsa carbonului în anumiți aminoacizi și acizi nucleici poate induce autofagie, lipsa de azot este stimulul cel mai eficient, valabil și pentru celulele vegetale..
Deși nu a fost pe deplin înțeles, celulele au „senzori” speciali pentru a determina când un nutrient sau un aminoacid esențial este în stare foarte scăzută și, astfel, declanșează întregul proces de reciclare prin lizozomi..
La mamifere, unii hormoni participă la reglarea (pozitivă sau negativă) a autofagiei în celulele aparținând anumitor organe, cum ar fi insulina, unii factori de creștere sau interleukine etc..
Tipuri
Există trei tipuri principale de autofagie printre eucariote: macro autofagie, micro autofagie și autofagie mediată de chaperonă. Dacă nu este specificat, termenul de autofagie se referă la autofagia macro..
Deși cele trei tipuri de autofagii sunt morfologic diferite, toate se termină prin transportul substanțelor către lizozomi pentru degradare și reciclare..
Macroautofagie
Acesta este un tip de autofagie care depinde de antrenament de novo a veziculelor fagocitare cunoscute sub numele de autofagozomi. Formarea acestor vezicule este independentă de formarea „mugurilor” de membrană, deoarece acestea se formează prin expansiune.
La drojdii, formarea autofagozomilor începe la un anumit loc cunoscut sub numele de PAS, în timp ce la mamifere apar multe situri diferite în citosol, probabil legate de reticulul endoplasmatic prin structuri cunoscute sub numele de „omegasomi”..
Mărimea autofagozomilor este foarte variabilă și depinde de organism și de tipul de moleculă sau organitel care este fagocitat. Poate varia de la 0,4-0,9 μm în diametru la drojdie până la 0,5-1,5 μm la mamifere..
Când membranele autofagozomului și lizozomului se fuzionează, conținutul acestora este amestecat și atunci începe digestia substraturilor țintă ale autofagiei. Acest organet este apoi cunoscut sub numele de autolizozom..
Pentru unii autori, macroautofagia poate fi subclasificată, la rândul ei, în autofagie indusă și autofagie de bază. Macroautofagia indusă este utilizată pentru a produce aminoacizi după o perioadă prelungită de foame.
Macroautofagia bazală se referă la mecanismul constitutiv (care este întotdeauna activ) esențial pentru rotația diferitelor componente citosolice și organite intracelulare.
Microautofagie
Acest tip de autofagie se referă la procesul în care conținutul citoplasmatic este introdus în lizozom prin invaginații care apar în membrana organului menționat..
Odată introduse în lizozom, veziculele produse de aceste invaginații plutesc liber în lumen până când sunt lizate și conținutul lor este eliberat și degradat de enzime specifice..
Autofagie mediată de chaperon
Acest tip de autofagie a fost raportat doar pentru celulele de mamifere. Spre deosebire de macro-autofagie și micro-autofagie, unde unele porțiuni citosolice sunt fagocitate nespecific, autofagia mediată de chaperoni este destul de specifică, deoarece depinde de prezența unor secvențe pentapeptidice particulare în substraturile care vor fi fagocitate..
Unii cercetători au stabilit că acest motiv pentapeptidic este legat de secvența KFERQ și că se găsește în mai mult de 30% din proteinele citosolice.
Se numește „mediată prin chaperonă”, deoarece proteinele chaperonice sunt responsabile de menținerea expusă a acestui motiv conservat pentru a facilita recunoașterea acestuia și pentru a preveni proteina să se plieze pe el..
Proteinele cu această etichetă sunt translocate în lumenul lizozomal și acolo sunt degradate. Multe dintre substraturile de degradare sunt enzime glicolitice, factori de transcripție și inhibitori ai acestora, proteine care leagă calciu sau lipide, subunități ale proteazomului și unele proteine implicate în traficul vezicular..
La fel ca celelalte două tipuri de autofagie, autofagia mediată de chaperonă este un proces reglementat la mai multe niveluri, de la recunoașterea etichetelor la transportul și degradarea substraturilor din lizozomi..
Caracteristici
Una dintre funcțiile principale ale procesului autofagic este eliminarea organelor senescente sau „învechite”, care sunt etichetate pe diferite căi pentru degradarea lor în lizozomi..
Datorită observării micrografiilor electronice ale lizozomilor în celulele mamiferelor, prezența peroxizomilor și a mitocondriilor a fost detectată în acestea..
Într-o celulă hepatică, de exemplu, durata medie de viață a mitocondriilor este de 10 zile, după care acest organet este fagocitat de lizozomi, unde este degradat și componentele sale sunt reciclate în diferite scopuri metabolice..
În condiții de concentrație scăzută de nutrienți, celulele pot declanșa formarea autofagozomilor pentru a „captura” selectiv porțiuni din citosol, precum și metaboliții digerați din acești autofagozomi pot ajuta celulele să supraviețuiască atunci când condițiile externe se limitează din punct de vedere. punct de vedere nutrițional.
Roluri în sănătate și dezvoltare
Autofagia are funcții importante în restructurarea celulelor în procesul de diferențiere, deoarece participă la eliminarea porțiunilor citosolice care nu sunt necesare la momente specifice..
De asemenea, are implicații importante pentru sănătatea celulelor, deoarece face parte din mecanismele de apărare împotriva virusurilor și bacteriilor invadatoare..
Studii Yoshinori Ohsumi
Yoshinori Ohsumi, cercetător japonez în fiziologie și medicină câștigător al Premiului Nobel pentru 2016, a descris mecanismele moleculare ale autofagiei în drojdie în timp ce studia soarta metabolică a multor proteine și vacuolele acestor organisme unicelulare..
În lucrarea sa, Ohsumi nu numai că a identificat proteinele și căile implicate în proces, dar a demonstrat și modul în care calea autofagiei este reglată grație acțiunii proteinelor capabile să „numere” diferite stări metabolice..
Munca lor a început cu observații microscopice precise ale vacuolelor în timpul evenimentelor intense de degradare. Vacuolele sunt considerate locurile de depozitare a „gunoiului” de drojdie și a resturilor celulare..
Prin observarea drojdiei cu genotipuri mutante defecte pentru diferite gene legate sau ipotetic legate de autofagie (cunoscute sub numele de gene ATG), acest cercetător și colaboratorii săi au reușit să descrie sistemul autofagic al drojdiilor la nivel genetic.
Ulterior, acest grup de cercetători au determinat principalele caracteristici genetice ale proteinelor codificate de aceste gene și au adus contribuții semnificative cu privire la interacțiunea lor și la formarea complexelor responsabile de inițierea și executarea autofagiei în drojdie..
Datorită muncii lui Yoshinori Ohsumi, astăzi înțelegem mai bine aspectele moleculare ale autofagiei, precum și implicațiile sale importante în funcționarea corectă a celulelor și organelor care ne compun..
Referințe
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K. și Walter, P. (2015). Biologia moleculară a celulei (Ed. A 6-a). New York: Garland Science.
- Klionsky, D. J. și Emr, S. D. (2000). Autofagia ca cale reglementată a degradării celulare. Ştiinţă, 290, 1717-1721.
- Mizushima, N. (2007). Autofagie: proces și funcție. Gene și dezvoltare, douăzeci și unu, 2861-2873.
- Mizushima, Noboru și Komatsu, M. (2011). Autofagie: Renovarea celulelor și a țesuturilor. Celula, 147, 728-741.
- Rabinowitz, J. D. și White, E. (2010). Autofagie și metabolism. Ştiinţă, 330, 1344-1348.

Nimeni nu a comentat acest articol încă.