
Benzil benzil hidrogen, carbocații, radicali benzilici
benzil sau benzil este un grup substituent comun în chimia organică a cărui formulă este C6H5CHDouă- sau Bn-. Structural constă pur și simplu în unirea unei grupări metilenice, CHDouă, cu o grupare fenil, C6H5; adică un carbon sp3 legat direct de un inel benzenic.
Prin urmare, gruparea benzii poate fi văzută ca un inel aromatic atașat la un lanț mic. În unele texte, utilizarea abrevierii Bn este preferată în locul lui C6H5CHDouă-, fiind ușor recunoscut în orice compus; mai ales atunci când este atașat la un atom de oxigen sau azot, O-Bn sau NBnDouă, respectiv.

Acest grup se găsește implicit și într-un număr de compuși cunoscuți pe scară largă. De exemplu, la acidul benzoic, C6H5COOH, ar putea fi considerat ca un benzil al cărui carbon sp3 a suferit o oxidare extinsă; sau benzaldehidă, C6H5CHO, dintr-o oxidare parțială; și alcool benzilic, C6H5CHDouăOH, și mai puțin ruginit.
Un alt exemplu oarecum evident al acestui grup poate fi găsit în toluen, C6H5CH3, care poate suferi un anumit număr de reacții ca urmare a stabilității neobișnuite rezultate din radicalii benzilici sau carbocații. Cu toate acestea, gruparea benzii servește la protejarea grupărilor OH sau NH.Două de reacții care modifică nedorit produsul care urmează a fi sintetizat.
Indice articol
- 1 Exemple de compuși cu grupare benzii
- 2 hidrogeni benzilici
- 3 Carbocatii si radicali benzilici
- 3.1 Rezonanță în gruparea benzii
- 3.2 Alți radicali
- 4 Reacții
- 5 Referințe
Exemple de compuși cu grupare benzii
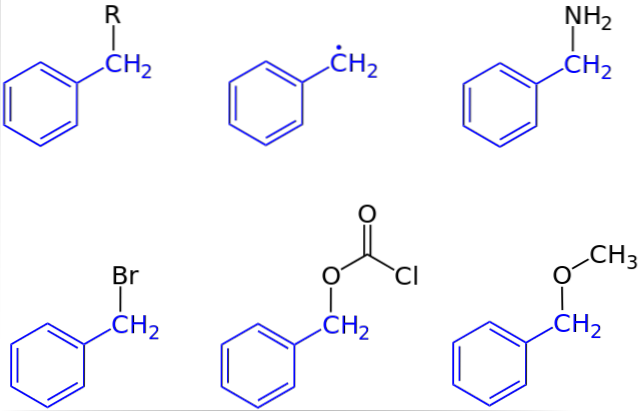
În prima imagine a fost prezentată reprezentarea generală a unui compus cu o grupare benzii: C6H5CHDouă-R, unde R poate fi orice alt fragment molecular sau atom. Astfel, prin variația R se poate obține un număr mare de exemple; unele simple, altele doar pentru o anumită regiune a unei structuri sau seturi mai mari.
Alcoolul benzilic, de exemplu, este derivat din substituirea OH cu R: C6H5CHDouă-OH. Dacă în locul OH este grupul NHDouă, atunci apare compusul benzilaminic: C6H5CHDouă-NHDouă.
Dacă Br este atomul care înlocuiește R, compusul rezultat este bromura de benzii: C6H5CHDouă-Br; R pentru CODouăCl dă naștere unui ester, clorocarbonat de benzii (sau clorură de carbobenzoxil); și OCH3 dă naștere benzil metil eter, C6H5CHDouă-OCH3.
Chiar (deși nu destul de corect), R poate fi asumat de un electron singuratic: radicalul benzilic, C6H5CHDouă·, Produs al eliberării radicalului R ·. Un alt exemplu, deși nu este inclus în imagine, este fenilacetonitrilul sau cianura de benzii, C6H5CHDouă-CN.
Există compuși în care gruparea benzil reprezintă cu greu o regiune specifică. Când acesta este cazul, abrevierea Bn este adesea utilizată pentru a simplifica structura și ilustrațiile sale..
Hidrogeni benzilici
Compușii de mai sus au în comun nu numai inelul aromatic sau fenilic, ci și hidrogenii benzilici; acestea sunt cele care aparțin carbonului sp3.
Astfel de hidrogeni pot fi reprezentați ca: Bn-CH3, Bn-CHDouăR sau Bn-CHRDouă. Compusul Bn-CR3 nu are hidrogen benzilic și, prin urmare, reactivitatea sa este mai mică decât cea a celorlalți.
Acești hidrogeni sunt diferiți de cei care sunt de obicei atașați la un carbon sp3.
De exemplu, luați în considerare metanul, CH4, care poate fi scris și ca CH3-H. Pentru ca legătura CH să se rupă3-H într-o defecțiune heterolitică (formare radicală), trebuie furnizată o anumită cantitate de energie (104kJ / mol).
Cu toate acestea, energia pentru aceeași legătură C se sparge6H5CHDouă-H este mai mic comparativ cu metanul (85 kJ / mol). Deoarece această energie este mai mică, aceasta implică faptul că radicalul C6H5CHDouăEste mai stabil decât CH3·. La fel se întâmplă într-un grad mai mare sau mai mic cu alți hidrogeni benzilici.
În consecință, hidrogenii benzilici sunt mai reactivi în generarea de radicali sau carbocații mai stabile decât cele cauzate de alți hidrogeni. De ce? Întrebarea are răspuns în secțiunea următoare.
Carbocații și radicalii benzilici
Radicalul C era deja luat în considerare6H5CHDouă·, Lipsit de carbocație benzilică: C6H5CHDouă+. În primul există un electron solitar nepereche, iar în al doilea un deficit electronic. Cele două specii sunt foarte reactive și reprezintă compuși tranzitorii din care provin produsele finale ale reacției..
Carbon sp3, după ce a pierdut unul sau doi electroni pentru a forma radicalul sau respectiv carbocația, poate adopta hibridizarea spDouă (plan trigonal), în așa fel încât să existe cea mai mică respingere posibilă între grupurile sale electronice. Dar, dacă se întâmplă să fie spDouă, La fel ca și carbonii inelari aromatici, poate avea loc conjugarea? Raspunsul este da.
Rezonanță în gruparea benzii
Această conjugare sau rezonanță este factorul cheie pentru a explica stabilitatea acestor specii benzilice sau derivate din benzii. Următoarea imagine ilustrează un astfel de fenomen:
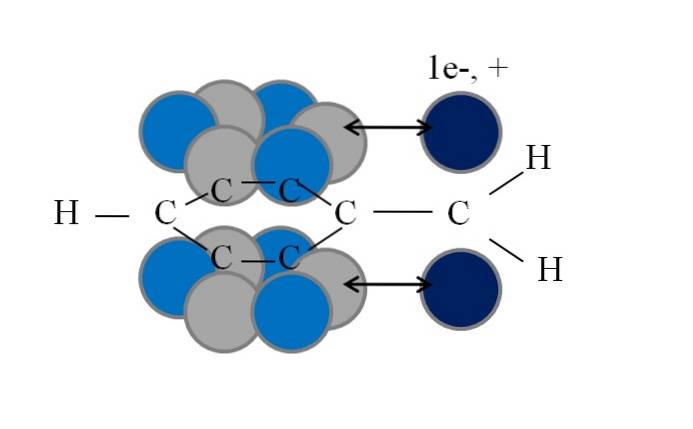
Rețineți că acolo unde se afla unul dintre hidrogenii benzilici, a rămas un orbital p cu un electron nepereche (radical, 1e-), sau nul (carbocație, +). După cum se poate vedea, acest orbital p este paralel cu sistemul aromatic (cercurile gri și albastru deschis), cu săgeata dublă care indică începutul conjugării.
Astfel, atât electronul nepereche, cât și sarcina pozitivă pot fi transferate sau dispersate prin inelul aromatic, deoarece paralelismul orbitalilor lor îl favorizează geometric. Cu toate acestea, acestea nu se află în niciun orbital p inel aromatic; numai în cele aparținând carbonilor în poziții orto și para față de CHDouă.
De aceea, cercurile de culoare albastru deschis ies în evidență deasupra celor gri: în ele se concentrează densitatea negativă sau pozitivă a radicalului sau respectiv a carbocației..
Alți radicali
Trebuie menționat faptul că această conjugare sau rezonanță nu pot apărea în carbonii sp3 cel mai îndepărtat de inelul aromatic.
De exemplu, radicalul C6H5CHDouăCHDouăEste mult mai instabil deoarece electronul nepereche nu se poate conjuga cu inelul atunci când intervine grupul CHDouă între și cu hibridizare sp3. Același lucru este valabil și pentru C6H5CHDouăCHDouă+.
Reacții
Pe scurt, hidrogenii benzilici sunt predispuși să reacționeze, generând fie un radical, fie o carbocație, care la rândul său ajunge să producă produsul final al reacției. Prin urmare, reacționează printr-un mecanism SN.1.
Un exemplu este bromurarea toluenului sub radiații ultraviolete:
C6H5CH3 + 1 / 2BrDouă => C6H5CHDouăFr
C6H5CHDouăBr + 1 / 2BrDouă => C6H5CHBrDouă
C6H5CHBrDouă + 1 / 2BrDouă => C6H5CBr3
De fapt, în această reacție se produc radicali Br..
Pe de altă parte, gruparea benzil în sine reacționează pentru a proteja grupările OH sau NH.Două într-o reacție simplă de substituție. Astfel, un alcool ROH poate fi „benzilat” folosind bromură de benzii și alți reactivi (KOH sau NaH):
ROH + BnBr => ROBn + HBr
ROBn este un eter benzilic, la care gruparea sa inițială OH poate fi returnată dacă este supusă unui mediu reductiv. Acest eter trebuie să rămână neschimbat în timp ce alte reacții sunt efectuate asupra compusului..
Referințe
- Morrison, R.T. și Boyd, R. N. (1987). Chimie organica. (Ediția a V-a). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Chimie organica. (Ediția a 6-a). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Wikipedia. (2019). Grupa benzilică. Recuperat de pe: en.wikipedia.org
- Dr. Donald L. Robertson. (5 decembrie 2010). Fenil sau benzil? Recuperat de la: home.miracosta.edu
- Gamini Gunawardena. (2015, 12 octombrie). Carbocație benzilică. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org


Nimeni nu a comentat acest articol încă.