
Structura bromurii de litiu, proprietăți, utilizări, riscuri
bromură de litiu este o sare neutră a unui metal alcalin a cărei formulă chimică este LiBr. Formula exprimă faptul că solidul său cristalin este compus din ioni Li+ și fr- într-un raport 1: 1. Cristalele sale sunt albe sau bej deschis. Este foarte solubil în apă și este, de asemenea, o sare destul de higroscopică..
Această ultimă proprietate permite utilizarea sa ca desicant în sistemele de climatizare și refrigerare. La fel, bromura de litiu a fost utilizată încă de la începutul secolului al XX-lea în tratamentul anumitor tulburări de sănătate mintală, utilizarea acesteia fiind abandonată din cauza utilizării inadecvate a sării.
LiBr este produs prin tratarea carbonatului de litiu, LiDouăCO3, cu acid bromhidric. După încălzirea mediului, precipită din soluția apoasă sub formă de hidrat..
Această sare irită pielea și ochii la contact, în timp ce provoacă iritarea căilor respiratorii prin inhalare. Ingerarea sărurilor de litiu poate provoca greață, vărsături, diaree și amețeli.
Indice articol
- 1 Structura bromurii de litiu
- 1.1 Hidrați și ochelari
- 2 Proprietăți
- 2.1 Greutatea moleculară
- 2.2 Aspect
- 2.3 Miros
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Solubilitatea în apă
- 2.7 Solubilitatea în solvenți organici
- 2.8 Indicele de refracție (ηD)
- 2.9 Capacitate termică
- 2.10 Entropie molară standard (Sθ 298)
- 2.11 Punct de aprindere
- 2.12 Stabilitate
- 2.13 Descompunerea
- 2,14 pH
- 2.15 Reactivitate
- 2.16 Producție
- 3 Nomenclatură
- 4 utilizări
- 4.1 Desicant
- 4.2 Fibre
- 4.3 Produse farmaceutice
- 4.4 Sedativ
- 5 Riscuri
- 5.1 Toxicitate de contact
- 5.2 Ingerare
- 6 Referințe
Structura bromurii de litiu
Formula LiBr arată clar că raportul Li / Br este egal cu 1; pentru fiecare cation Li+ trebuie să existe un anion Br- echivalent. Prin urmare, acest raport trebuie menținut constant în toate colțurile cristalului LiBr..
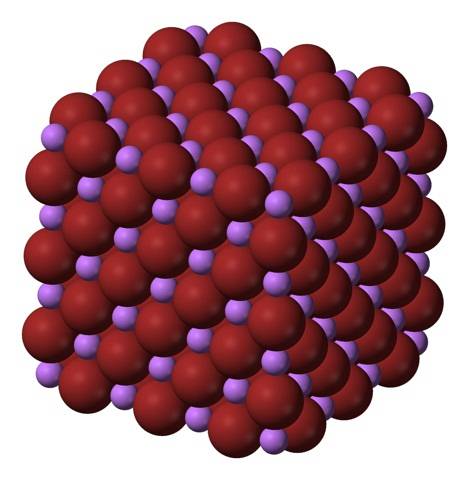
Li ionii+ și fr- se atrag reciproc, scăzând repulsiile între sarcini egale, pentru a proveni în acest fel un cristal cub ca sarea de bijuterie; acest lucru este izomorf pentru NaCl (imaginea de sus). Rețineți că, în sine, întregul set are o geometrie cubică.
În acest cristal, Li+ sunt mai mici și au o culoare violet deschis; în timp ce fr- sunt mai voluminoase și de o culoare maro intens. Se observă că fiecare ion are șase vecini, ceea ce înseamnă că prezintă o coordonare octaedrică: LiBr6 sau Li6Br; totuși, dacă este luată în considerare celula unitară, raportul Li / Br rămâne 1.
Aceasta este structura cristalină adoptată de preferință de LiBr. Cu toate acestea, poate forma și alte tipuri de cristale: wurzite, dacă cristalizează la temperaturi scăzute (-50 ° C) pe un substrat; sau cubic centrat pe corp, sau de tip CsCl, dacă cristalul de sare de bijuterie cubică este supus la presiune ridicată.
Hidrati si ochelari
Cele de mai sus se aplică pentru LiBr anhidru. Această sare este higroscopică și, prin urmare, poate absorbi umezeala din mediu, introducând molecule de apă în propriile cristale. Astfel, apar hidrații LiBrnHDouăO (n = 1, 2, 3 ..., 10). Pentru fiecare hidrat, structura cristalină este diferită.
De exemplu, studiile cristalografice au determinat că LiBrHDouăSau adoptați o structură asemănătoare perovskitului.
Când acești hidrați se află în soluție apoasă, pot să se răcească și să se vitrifice; adică adoptă o structură aparent cristalină dar dezordonată molecular. În astfel de condiții, legăturile de hidrogen din apă devin destul de importante..
Proprietăți
Greutate moleculară
88,845 g / mol.
Aspect
Solid cristalin alb sau bej deschis.
Miros
Toaletă.
Punct de topire
552 ºC (1.025 ºF, 825 K).
Punct de fierbere
1.256 ºC (2.309 ºF, 1.538 K).
Solubilitatea apei
166,7 g / 100 ml la 20 ° C. Rețineți solubilitatea ridicată.
Solubilitate în solvenți organici
Solubil în metanol, etanol, eter și acetonă. Ușor solubil în piridină, un compus aromatic și mai puțin polar decât precedentele.
Indicele de refracție (ηD)
1.784.
Capacitatea calorică
51,88 J / mol K.
Entropie molară standard (Sθ 298)
66,9 J / mol K.
punctul de aprindere
1.265 ° C. Este considerat neinflamabil.
Stabilitate
Grajd. Cu toate acestea, forma anhidră este extrem de higroscopică.
Descompunere
Atunci când se descompune prin încălzire, produce oxid de litiu.
pH
Între pH 6 și 7 în soluție apoasă (100 g / L, 20 ° C).
Reactivitate
Bromura de litiu nu este reactivă în condiții normale de mediu. Cu toate acestea, puteți experimenta reacții puternice cu acizi puternici pe măsură ce temperatura crește..
La dizolvarea în apă, există o creștere a temperaturii, cauzată de o entalpie negativă de hidratare.
Producție
LiBr este produs prin reacția hidroxidului de litiu sau a carbonatului de litiu cu acidul bromhidric într-o reacție de neutralizare:
LiDouăCO3 + HBr => LiBr + CODouă + HDouăSAU
Bromura de litiu se obține sub formă de hidrat. Pentru a obține forma anhidră, este necesar să încălziți sarea hidratată sub vid..
Nomenclatură
Denumirea de „bromură de litiu” derivă din faptul că este o halogenură metalică, numită astfel în conformitate cu nomenclatura stocului. Alte denumiri, la fel de valabile, dar mai puțin utilizate, sunt monobromura de litiu, conform nomenclaturii sistematice; și bromură litică (valența unică a +1 pentru litiu), conform nomenclaturii tradiționale.
Aplicații
Desicant
LiBr este o sare higroscopică, formând o saramură concentrată capabilă să absoarbă umezeala din aer pe o gamă largă de temperaturi. Această saramură este utilizată ca desicant în sistemele de climatizare și refrigerare..
Fibrele
Se folosește pentru creșterea volumului de lână, păr și alte fibre organice.
Produse farmaceutice
LiBr formează aducti cu unii compuși farmaceutici, modulându-le acțiunea. Un aduct este combinația prin coordonare a două sau mai multe molecule, fără a produce o alterare structurală a oricăreia dintre moleculele unite.
Sedativ
Bromura de litiu a fost folosită pentru prima dată ca sedativ în anumite tulburări mintale și a fost întreruptă în 1940. În prezent, se folosește carbonat de litiu; dar în orice caz, litiul este elementul care exercită acțiunea terapeutică în ambii compuși.
Litiu este utilizat în tratamentul tulburării bipolare, fiind util în controlul episoadelor maniacale ale tulburării. Se crede că litiul inhibă activitatea neurotransmițătorilor excitatori, cum ar fi dopamina și acidul glutamic..
Pe de altă parte, crește activitatea sistemului inhibitor mediat de neurotransmițătorul acid gamma-amino-butiric (GABA). Aceste acțiuni ar putea face parte din baza acțiunii terapeutice a litiului.
Riscuri
Toxicitate de contact
Iritarea și sensibilizarea pielii, alergii. Leziuni oculare grave sau iritații la nivelul ochilor, căilor respiratorii, pasajelor nazale și gâtului.
Ingerare
Principalele simptome datorate ingestiei de bromură de litiu sunt: tulburări gastro-intestinale, vărsături și greață. Alte efecte adverse ale ingerării sării includ agitație, spasme și pierderea cunoștinței..
Condiția cunoscută sub numele de „bromism” poate apărea cu doze de bromură de litiu mai mari de 225 mg / zi..
Unele dintre următoarele semne și simptome pot apărea în glume: exacerbarea acneei și pierderea poftei de mâncare, tremurături, probleme de vorbire, apatie, slăbiciune și agitație maniacală.
Referințe
- Formulare chimică. (2019). Bromură de litiu. Recuperat de pe: formulacionquimica.com
- David C. Johnson. (10 iulie 2008). Nouă comandă pentru bromură de litiu. Natură. doi.org/10.1038/454174a
- Aayushi Jain și R.C. Dixit. (s.f.). Tranziția fazei structurale în bromură de litiu: efectul presiunii și temperaturii. [PDF]. Recuperat de la: ncpcm.in
- Takamuku și colab. (1997). Studii de difracție cu raze X pe soluții apoase de răcire cu bromură de litiu și soluții de iodură de litiu. Departamentul de Chimie, Facultatea de Științe, Universitatea Fukuoka, Nanakuma, Jonan-ku, Fukuoka 814-80, Japonia.
- Centrul Național pentru Informații despre Biotehnologie. (2019). Bromură de litiu. Baza de date PubChem, CID = 82050. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Bromură de litiu. Recuperat de pe: en.wikipedia.org
- Societatea Regală de Chimie. (2019). Bromură de litiu. Chemspider. Recuperat de pe: chemspider.com



Nimeni nu a comentat acest articol încă.