
Structura, proprietățile și utilizările bromurii de argint (AgBr)
bromură de argint este o sare anorganică a cărei formulă chimică este AgBr. Solidul său este format din cationi Ag+ și anioni Br- într-un raport 1: 1, atras de forțe electrostatice sau legături ionice. Se poate vedea ca și cum argintul metalic ar fi dat unul dintre electronii de valență bromului molecular.
Natura sa seamănă cu „frații” săi clorură de argint și iodură. Toate cele trei săruri sunt insolubile în apă, au culori similare și sunt, de asemenea, sensibile la lumină; adică suferă reacții fotochimice. Această proprietate a fost utilizată pentru obținerea fotografiilor, ca urmare a reducerii ionilor de Ag+ la argint metalic.
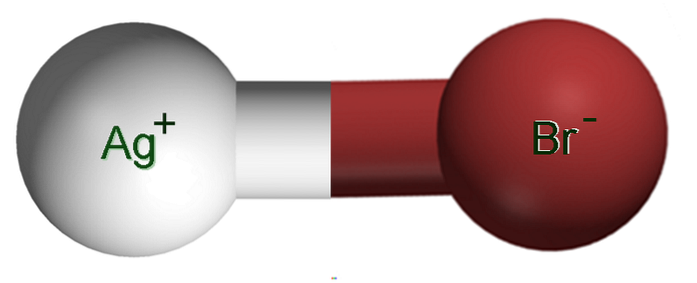
Imaginea de mai sus prezintă o pereche de ioni Ag+Fr-, în care sferele albe și maronii corespund ionilor Ag+ și fr-, respectiv. Aici ele reprezintă legătura ionică ca Ag-Br, dar este necesar să se indice că nu există o astfel de legătură covalentă între ambii ioni.
Poate părea contradictoriu faptul că argintul este cel care contribuie cu culoarea neagră la fotografiile fără culoare. Acest lucru se datorează faptului că AgBr reacționează cu lumina, generând o imagine latentă; care, atunci, se intensifică prin creșterea reducerii argintului.
Indice articol
- 1 Structura bromurii de argint
- 1.1 Defecte de cristal
- 2 Sinteza
- 3 Proprietăți
- 3.1 Aspect
- 3.2 Masa moleculară
- 3.3 Densitatea
- 3.4 Punctul de topire
- 3.5 Punctul de fierbere
- 3.6 Solubilitate în apă
- 3.7 Indicele de refracție
- 3.8 Capacitate termică
- 3.9 Sensibilitate la lumină
- 4 utilizări
- 5 Referințe
Structura bromurii de argint
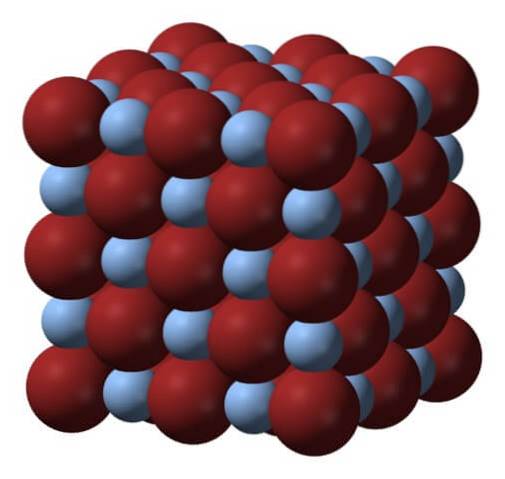
Deasupra se află rețeaua sau structura cristalină a bromurii de argint. Iată o reprezentare mai fidelă a diferenței de dimensiune între razele ionice ale Ag+ și fr-. Br anioni-, mai voluminoase, lasă interstiții unde se află cationii Ag+, care este înconjurat de șase fr- (si invers).
Această structură este caracteristică unui sistem cristalin cubic, în special al tipului de sare de rocă; la fel, de exemplu, ca și pentru clorura de sodiu, NaCI. De fapt, imaginea facilitează acest lucru aranjând o delimitare cubică perfectă.
La prima vedere se poate observa că există o anumită diferență de dimensiune între ioni. Aceasta, și poate caracteristicile electronice ale Ag+ (și posibilul efect al unor impurități), duce la manifestarea defectelor de cristale AgBr; adică locuri în care secvența de ordonare a ionilor din spațiu este „ruptă”.
Defecte de cristal
Aceste defecte constau în goluri lăsate de ioni absenți sau deplasați. De exemplu, între șase anioni Br- în mod normal cationul Ag ar trebui să fie+; dar, în schimb, poate exista un gol datorită faptului că argintul s-a mutat într-un alt decalaj (defect Frenkel).
Deși afectează rețeaua de cristal, favorizează reacțiile argintului cu lumina; și cu cât cristalele sau grupul lor (dimensiunea boabelor) sunt mai mari, cu atât numărul defectelor este mai mare și, prin urmare, va fi mai sensibil la lumină. La fel, impuritățile influențează structura și această proprietate, în special cele care pot fi reduse cu electronii..
Ca o consecință a acestuia din urmă, cristalele mari de AgBr necesită o expunere mai mică la lumină pentru a le reduce; adică sunt mai de dorit în scopuri fotografice.
Sinteză
În laborator, bromura de argint poate fi sintetizată prin amestecarea unei soluții apoase de azotat de argint, AgNO3, cu sarea bromurii de sodiu, NaBr. Prima sare contribuie cu argintul, iar a doua bromură. Ceea ce urmează este o reacție de dublă deplasare sau metateză care poate fi reprezentată de ecuația chimică de mai jos:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Rețineți că sarea de azotat de sodiu, NaNO3, este solubil în apă, în timp ce AgBr precipită ca un solid cu o culoare galbenă slabă. Ulterior, solidul este spălat și supus uscării în vid. Pe lângă NaBr, KBr ar putea fi utilizat și ca sursă de anioni bromură.
Pe de altă parte, AgBr poate fi obținut în mod natural prin bromiritul mineral și prin procesele sale de purificare..
Proprietăți
Aspect
Solid argilos, galben-albicios.
Masa moleculara
187,77 g / mol.
Densitate
6,473 g / ml.
Punct de topire
432 ° C.
Punct de fierbere
1502 ° C.
Solubilitatea apei
0,140 g / ml la 20 ° C.
Indicele de refracție
2.253.
Capacitate de căldură
270 J / Kg K.
Sensibilitate la lumină
S-a spus în secțiunea anterioară că există defecte în cristalele de AgBr care promovează sensibilitatea acestei sări la lumină, deoarece prind electronii formați; și astfel, teoretic, li se împiedică să reacționeze cu alte specii din mediu, cum ar fi oxigenul din aer.
Electronul este eliberat din reacția Br- cu un foton:
Fr- + hv => 1 / 2BrDouă + și-
Rețineți că Br este produsDouă, care va pata roșu continuu dacă nu este îndepărtat. Electronii eliberați reduc cationii Ag+, în interstițiile sale, la argint metalic (uneori reprezentat ca Ag0):
Ag+ + și- => Ag
Având atunci ecuația netă:
AgBr => Ag + 1 / 2BrDouă
Când „primele straturi” de argint metalic se formează la suprafață, se spune că există o imagine latentă, încă invizibilă pentru ochiul uman. Această imagine devine de milioane de ori mai vizibilă dacă o altă specie chimică (cum ar fi hidrochinona și fenidona, în procesul de dezvoltare) mărește reducerea cristalelor de AgBr la argint metalic.
Aplicații

Bromura de argint este cea mai utilizată dintre toate halogenurile sale în domeniul dezvoltării filmului fotografic. AgBr se aplică pe respectivele filme, realizate cu acetat de celuloză, suspendate în gelatină (emulsie fotografică) și în prezența 4- (metilamino) fenol sulfat (Metol) sau fenidonă și hidrochinonă.
Cu toți acești reactivi, imaginea latentă poate fi adusă la viață; terminați și accelerați transformarea argintului ionic în metalic. Dar, dacă nu procedați cu o anumită grijă și experiență, tot argintul de la suprafață se va oxida, iar contrastul dintre culorile alb-negru se va termina..
De aceea, etapele de oprire, fixare și scufundare a filmelor fotografice sunt vitale..
Există artiști care se joacă cu aceste procese în așa fel încât să creeze nuanțe de gri, care îmbogățesc frumusețea imaginii și propria moștenire; și fac toate acestea, uneori poate fără să bănuiți, datorită reacțiilor chimice, a căror bază teoretică poate deveni puțin complexă și unui AgBr sensibil la lumină care marchează un punct de plecare.
Referințe
- Wikipedia. (2019). Bromură de argint. Recuperat de pe: en.wikipedia.org
- Michael W. Davidson. (2015, 13 noiembrie). Galerie de imagini digitale cu lumină polarizată: Bromură de argint. Olimp. Recuperat de pe: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Bromură de argint (AgBr). Recuperat de pe: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann și Claudia Schneeweiss. (29 iunie 2004). Emulsii auto-realizate pe bază de bromură de argint pentru utilizatorii în holografie: fabricare, prelucrare și aplicare, Proc. SPIE 5290, Holografie practică XVIII: Materiale și aplicații; doi: 10.1117 / 12.525035; https://doi.org/10.1117/12.525035
- Alan G. Shape. (1993). Chimie anorganică. (A doua editie.). Editorial Reverté.
- Carlos Güido și Ma Eugenia Bautista. (2018). Introducere în chimia fotografică. Recuperat de pe: fotografia.ceduc.com.mx
- García D. Bello. (9 ianuarie 2014). Chimie, fotografie și Chema Madoz. Recuperat din: dimetilsulfuro.es



Nimeni nu a comentat acest articol încă.