
Definiția masei atomice, tipuri, modul de calcul, exemple

masă atomică este cantitatea de materie prezentă într-un atom, care poate fi exprimată în unități fizice obișnuite sau în unități de masă atomică (uma sau u). Un atom este gol în cea mai mare parte a structurii sale; electroni care sunt difuzați în regiuni numite orbitali, unde există o anumită probabilitate de a le găsi și nucleul lor.
Protonii și neutronii se găsesc în nucleul atomului; primul cu sarcini pozitive, în timp ce cel din urmă cu sarcini neutre. Aceste două particule subatomice au o masă mult mai mare decât cea a electronului; Prin urmare, masa unui atom este guvernată de nucleul său și nu de vid și nici de electroni.
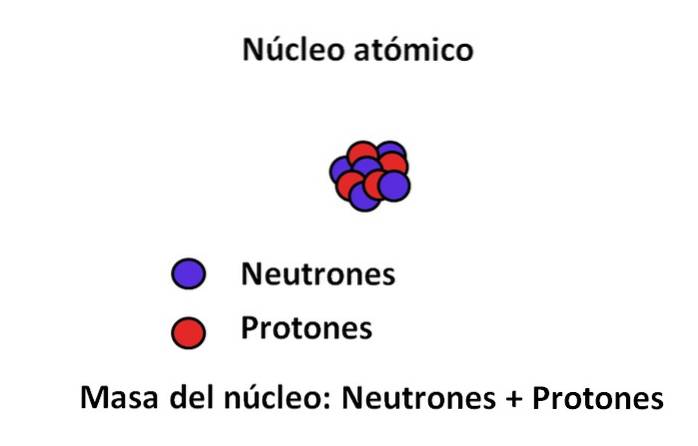
Masa unui electron este de aproximativ 9,110-31 kg, în timp ce cel al protonului 1.67 · 10-27 kg, raportul de masă fiind de 1.800; adică un proton „cântărește” de 1.800 de ori mai mult decât un electron. În mod similar, același lucru se întâmplă cu masele neutronului și electronului. De aceea, contribuția în masă a electronului în scopuri obișnuite este considerată neglijabilă..
Din această cauză, se presupune adesea că masa atomului sau masa atomică depinde doar de masa nucleului; care, la rândul său, constă din suma materiei neutronilor și protonilor. Din acest raționament ies două concepte: numărul masei și masa atomică, ambele strâns legate..
Există atât de mult „vid” în atomi și, deoarece masa lor este aproape în întregime o funcție a nucleului, este de așteptat ca acesta din urmă să fie extraordinar de dens..
Dacă eliminăm golul menționat din orice corp sau obiect, dimensiunile acestuia s-ar contracta drastic. De asemenea, dacă am putea construi un obiect mic bazat pe nuclei atomici (fără electroni), atunci ar avea o masă de milioane de tone..
Pe de altă parte, masele atomice ajută la distingerea diferiților atomi ai aceluiași element; acestea sunt izotopii. Deoarece există izotopi mai abundenți decât alții, trebuie estimată o medie a maselor atomilor pentru un anumit element; medie care poate varia de la o planetă la alta sau de la o regiune spațială la alta.
Indice articol
- 1 Definiție și concept
- 1.1 Unitatea de masă atomică
- 1.2 Echivalența în grame
- 2 Masa atomică medie
- 2.1 Exemplu
- 3 Masa atomică absolută
- 4 Masa atomică relativă
- 5 Cum se calculează masa atomică
- 6 Exemple
- 6.1 Carbon
- 6.2 Sodiu
- 6.3 Oxigen
- 6.4 Azot
- 6.5 Clor
- 6.6 Disproziu
- 7 Referințe
Definiție și concept
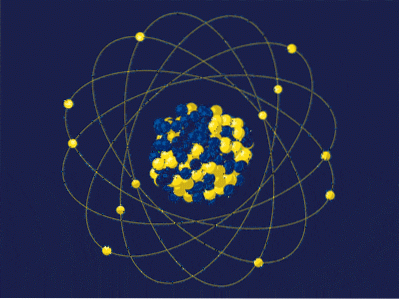
Prin definiție, masa atomică este suma maselor protonilor și neutronilor săi, exprimată cu uma sau u. Numărul rezultat (numit uneori și număr de masă) este plasat adimensional în colțul din stânga sus în notația utilizată pentru nuclizi. De exemplu, pentru element cincisprezeceX masa sa atomică este 15uma sau 15u.
Masa atomică nu poate spune prea multe despre adevărata identitate a acestui element X. În schimb, se folosește numărul atomic, care corespunde protonilor din nucleul lui X. Dacă acest număr este 7, atunci diferența (15-7) va fi egal cu 8; adică X are 7 protoni și 8 neutroni, a căror sumă este 15.
Revenind la imagine, nucleul are 5 neutroni și 4 protoni, deci numărul său de masă este 9; iar la rândul său, 9 amu este masa atomului său. Având 4 protoni și consultând tabelul periodic, se poate vedea că acest nucleu corespunde cu cel al elementului beriliu, Be (sau 9Fi).
Unitatea de masă atomică
Atomii sunt prea mici pentru a-și putea măsura masele prin metode convenționale sau balanțe obișnuite. Din acest motiv a fost inventat uma, u sau Da (daltonism). Aceste unități concepute pentru atomi vă permit să aveți o idee despre cât de masivi sunt atomii unui element unul în raport cu celălalt..
Dar ce reprezintă mai exact un amu? Trebuie să existe o referință care să permită stabilirea relațiilor de masă. Pentru aceasta, atomul a fost folosit ca referință 12C, care este cel mai abundent și stabil izotop pentru carbon. Având 6 protoni (numărul său atomic Z) și 6 neutroni, masa sa atomică este deci 12.
Se presupune că protonii și neutronii au aceleași mase, astfel încât fiecare contribuie cu 1 amu. Unitatea de masă atomică este apoi definită ca o doisprezecime (1/12) din masa unui atom de carbon-12; aceasta este masa unui proton sau neutron.
Echivalența în grame
Și acum apare următoarea întrebare: câte grame este egal cu 1 amu? Întrucât la început nu existau tehnici suficient de avansate pentru ao măsura, chimiștii au trebuit să se mulțumească cu exprimarea tuturor maselor cu amu; totuși, acesta a fost un avantaj și nu un dezavantaj.
De ce? Deoarece particulele subatomice sunt atât de mici, masa lor, exprimată în grame, trebuie să fi fost la fel de mică. De fapt, 1 amu este egal cu 1.6605 · 10-24 grame. În plus, odată cu utilizarea conceptului de aluniță, nu a fost o problemă să lucrăm masele elementelor și izotopii lor cu amu știind că astfel de unități ar putea fi modificate la g / mol.
De exemplu, revenirea la cincisprezeceX și 9Fie, avem că masele lor atomice sunt 15 amu și respectiv 9 amu. Deoarece aceste unități sunt atât de mici și nu indică direct cantitatea de materie pe care trebuie să o "cântărească" pentru a le manipula, ele sunt transformate în masele lor molare respective: 15 g / mol și 9 g / mol (introducând conceptele de moli și numărul lui Avogadro ).
Masa atomică medie
Nu toți atomii din același element au aceeași masă. Aceasta înseamnă că trebuie să aibă mai multe particule subatomice în nucleu. Fiind același element, numărul atomic sau numărul de protoni trebuie să rămână constant; prin urmare, există doar variații în cantitățile de neutroni pe care le posedă.
Așa apare din definiția izotopilor: atomi ai aceluiași element, dar cu mase atomice diferite. De exemplu, beriliu constă aproape în întregime din izotop 9Fii, cu urme de 10Fi. Cu toate acestea, acest exemplu nu este foarte util în înțelegerea conceptului de masă atomică medie; avem nevoie de unul cu mai mulți izotopi.
Exemplu
Să presupunem că elementul există 88J, acesta fiind principalul izotop al lui J cu o abundență de 60%. J are, de asemenea, alți doi izotopi: 86J, cu o abundență de 20% și 90J, cu o abundență, de asemenea, de 20%. Aceasta înseamnă că din 100 de atomi J pe care îi colectăm pe Pământ, 60 dintre ei sunt 88J, iar restul de 40 un amestec de 86J și 90J.
Fiecare dintre cei trei izotopi ai lui J are propria sa masă atomică; adică suma lor de neutroni și protoni. Cu toate acestea, aceste mase trebuie să fie calculate pentru a avea o masă atomică pentru J; aici pe Pământ, deoarece pot exista și alte regiuni ale Universului în care abundența 86J este 56% și nu 60%.
Pentru a calcula masa atomică medie a lui J, trebuie obținută media ponderată a maselor izotopilor săi; adică luând în considerare procentul de abundență pentru fiecare dintre ele. Astfel avem:
Masa medie (J) = (86 amu) (0,60) + (88 amu) (0,20) + (90 amu) (0,20)
= 87,2 amu
Adică, masa atomică medie (cunoscută și sub numele de greutatea atomică) a lui J este de 87,2 amu. Între timp, masa sa molară este de 87,2 g / mol. Rețineți că 87.2 este mai aproape de 88 decât de 86 și, de asemenea, este distanță de 90.
Masa atomică absolută
Masa atomică absolută este masa atomică exprimată în grame. Plecând de la exemplul elementului ipotetic J, putem calcula masa sa atomică absolută (cea a mediei) știind că fiecare amu este echivalent cu 1.6605 · 10-24 grame:
Masa atomică absolută (J) = 87,2 amu * (1.6605 · 10-24 g / am)
= 1.447956 10-22 g / atom J
Aceasta înseamnă că, în medie, atomii J au o masă absolută de 1,447956 · 10-22 g.
Masa atomică relativă
Masa atomică relativă numeric este identică cu masa atomică medie pentru un element dat; Cu toate acestea, spre deosebire de al doilea, primului îi lipsește unitatea. Prin urmare, este adimensional. De exemplu, masa atomică medie a beriliului este de 9,012182 u; în timp ce masa sa relativă atomică este pur și simplu 9,012182.
De aceea, aceste concepte sunt uneori interpretate greșit ca sinonime, deoarece sunt foarte asemănătoare și diferențele dintre ele sunt subtile. Dar cu ce sunt aceste mase? Relativ la o doisprezecime din masa 12C.
Astfel, un element cu o masă atomică relativă de 77 înseamnă că are o masă de 77 de ori mai mare decât 1/12 din 12C.
Cei care au privit elementele din tabelul periodic vor vedea că masele lor sunt relativ exprimate. Nu au unități de amu și se interpretează ca: fierul are o masă atomică de 55,846, ceea ce înseamnă că este de 55,846 ori mai mare decât masa de 1/12 din 12C și care poate fi exprimat și ca 55,846 amu sau 55,846 g / mol.
Cum se calculează masa atomică
Din punct de vedere matematic, s-a dat un exemplu de calcul al acestuia cu exemplul elementului J. În termeni generali, trebuie aplicată formula medie ponderată, care ar fi:
P = Σ (masa atomică izotopică) (abundență în zecimale)
Cu alte cuvinte, având masele atomice (neutroni + protoni) ai fiecărui izotop (în mod normal natural) pentru un anumit element, precum și abundențele lor terestre respective (sau oricare ar fi regiunea luată în considerare), atunci se poate calcula media ponderată..
Și de ce nu doar media aritmetică? De exemplu, masa atomică medie a lui J este de 87,2 amu. Dacă calculăm din nou această masă, dar aritmetic, vom avea:
Masa medie (J) = (88 amu + 86 amu + 90 amu) / 3
= 88 amu
Rețineți că există o diferență importantă între 88 și 87.2. Acest lucru se datorează faptului că media aritmetică presupune că abundența tuturor izotopilor este aceeași; Deoarece există trei izotopi ai lui J, fiecare ar trebui să aibă o abundență de 100/3 (33,33%). Dar acest lucru nu este cazul în realitate: există izotopi mult mai abundenți decât alții.
De aceea se calculează media ponderată, deoarece ține cont de cât de abundent este un izotop față de altul..
Exemple
Carbon
Pentru a calcula masa atomică medie de carbon avem nevoie de izotopii săi naturali cu abundențele lor respective. În cazul carbonului, acestea sunt: 12C (98,89%) și 13C (1,11%). Masele lor atomice relative sunt 12 și, respectiv, 13, care la rândul lor sunt egale cu 12 amu și 13 amu. Rezolvarea:
Masa atomică medie (C) = (12 amu) (0.9889) + (13 amu) (0.0111)
= 12.0111 amu
Prin urmare, masa unui atom de carbon este în medie 12,01 amu. Deoarece există urme de 14C, nu are aproape nicio influență asupra acestei medii.
Sodiu
Toți atomii de sodiu terestri constau din izotop 2. 3Na, deci abundența sa este de 100%. De aceea, în calculele obișnuite, masa sa poate fi presupusă a fi pur și simplu 23 amu sau 23 g / mol. Cu toate acestea, masa sa exactă este 22.98976928 amu.
Oxigen
Cei trei izotopi ai oxigenului cu abundențele respective sunt: 16O (99,762%), 17O (0,038%) și 18O (0,2%). Avem totul pentru a-i calcula masa atomică medie:
Masa atomică medie (O) = (16 amu) (0,99762) + (17 amu) (0,00038) + (18 amu) (0,002)
= 16.00438 amu
Deși masa exactă raportată este de fapt 15.9994 amu.
Azot
Repetând aceiași pași cu oxigen avem: 14N (99,634%) și cincisprezeceN (0,366%). Atunci:
Masa atomică medie (N) = (14 amu) (0,99634) + (15 amu) (0,00366)
= 14.00366 amu
Rețineți că masa raportată pentru azot este de 14.0067 amu, puțin mai mare decât cea calculată de noi.
Clor
Izotopii clorului cu abundențele respective sunt: 35Cl (75,77%) și 37Cl (24,23%). Calculând masa sa atomică medie avem:
Masa atomică medie (Cl) = (35 amu) (0,7577) + (37 amu) (0,2423)
= 35,4846 amu
Foarte similar cu cel raportat (35.453 amu).
Disproziu
Și, în cele din urmă, se va calcula masa medie a unui element cu mulți izotopi naturali: disproziul. Acestea și cu abundențele lor respective sunt: 156Dy (0,06%), 158Vopsea (0,10%), 160Vopsea (2,34%), 161Dy (18,91%), 162Vopsea (25,51%), 163Dy (24,90%) și 164Dy (28,18%).
Procedăm ca în exemplele anterioare pentru a calcula masa atomică a acestui metal:
Masa atomică medie (Dy) = (156 amu) (0.0006%) + (158 amu) (0.0010) + (160 amu) (0.0234) + (161 amu) (0.1891) + (162 amu) (0.2551) + (163 amu) (0,2490) + (164 amu) (0,2818)
= 162.5691 amu
Masa raportată este de 162.500 amu. Rețineți că această medie este între 162 și 163, deoarece izotopii 156Dy, 158Dy și 160Dy sunt puțini abundenți; în timp ce cele care predomină sunt 162Dy, 163Dy și 164Dy.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2019). Masă atomică. Recuperat de pe: en.wikipedia.org
- Christopher Masi. (s.f.). Masa atomică. Recuperat de pe: wsc.mass.edu
- Natalie Wolchover. (12 septembrie 2017). Cum cântăriți un atom? Știința vie. Recuperat de pe: livescience.com
- Chimie LibreTexte. (05 iunie 2019). Calculul maselor atomice. Recuperat de la: chem.libretexts.orgs
- Edward Wichers și H. Steffen Peiser. (15 decembrie 2017). Greutate atomica. Encyclopædia Britannica. Recuperat de pe: britannica.com



Nimeni nu a comentat acest articol încă.