
Caracteristicile butenei, structura chimică și utilizări
butene este numele dat unei serii de patru izomeri cu formula chimică C4H8. Sunt alchene sau olefine, adică au o legătură dublă C = C în structura lor. În plus, acestea sunt hidrocarburi, care pot fi găsite în zăcăminte petroliere sau originate prin fisurare termică și obțin produse de greutate moleculară mai mică..
Cei patru izomeri reacționează cu oxigenul, eliberând căldură și o flacără galbenă. De asemenea, pot reacționa cu un spectru larg de molecule mici care se adaugă la dubla lor legătură..
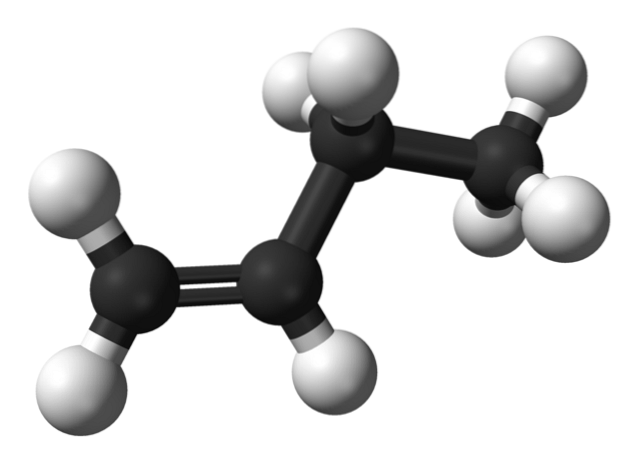
Dar care sunt izomerii butenei? În imaginea superioară structura este reprezentată cu sfere albe (hidrogen) și negru (carboni) pentru 1-butenă. 1-Butena este cel mai simplu izomer al hidrocarburii C4H8. Rețineți că există opt sfere albe și patru sfere negre, ceea ce este de acord cu formula chimică.
Ceilalți trei izomeri sunt cis și trans-2-butenă și izo-butenă. Toate acestea prezintă proprietăți chimice foarte similare, deși structurile lor provoacă variații ale proprietăților fizice (puncte de topire și fierbere, densități etc.). De asemenea, spectrele lor IR au modele similare de benzi de absorbție..
În mod colocvial, 1-butena este numită butenă, deși 1-butena se referă doar la un singur izomer și nu la un nume generic. Acești patru compuși organici sunt gaze, dar se pot lichefia la presiuni ridicate sau se pot condensa (și chiar cristaliza) cu o scădere a temperaturii..
Sunt o sursă de căldură și energie, reactivi pentru sinteza altor compuși organici și, mai ales, necesari pentru fabricarea cauciucului artificial după sinteza butadienei..
Indice articol
- 1 Caracteristicile butenei
- 1.1 Greutate moleculară
- 1.2 Aspecte fizice
- 1.3 Punctul de fierbere
- 1.4 Punct de topire
- 1.5 Solubilitate
- 1.6 Densitate
- 1.7 Reactivitate
- 2 Structura chimică
- 2.1 Izomeri constituționali și geometrici
- 2.2 Stabilitate
- 2.3 Forțe intermoleculare
- 3 utilizări
- 4 Referințe
Caracteristicile butenei
Greutate moleculară
56,106 g / mol. Această greutate este aceeași pentru toți izomerii cu formula C4H8.
Aspecte fizice
Este un gaz incolor și inflamabil (ca și ceilalți izomeri) și are un miros relativ aromat..
Punct de fierbere
Punctele de fierbere pentru izomerii butenei sunt după cum urmează:
1-butenă: -6ºC
Cis-2-butenă: 3,7ºC
Trans-2-butenă: 0,96ºC
2-metilpropenă: -6,9ºC
Punct de topire
1-butenă: -185,3ºC
Cis-2-butenă: -138,9ºC
Trans-2-butenă: -105,5ºC
2-metilpropenă: -140,4ºC
Solubilitate
Butena este foarte insolubilă în apă datorită naturii sale nepolare. Cu toate acestea, se dizolvă perfect în unii alcooli, benzen, toluen și eteri..
Densitate
0,577 la 25 ° C. Prin urmare, este mai puțin dens decât apa și într-un recipient ar fi amplasat deasupra acestuia..
Reactivitate
La fel ca orice alchenă, dubla sa legătură este susceptibilă de a adăuga molecule sau de a se oxida. Acest lucru face ca butena și izomerii săi să fie reactivi. Pe de altă parte, acestea sunt substanțe inflamabile, așa că atunci când sunt supraîncălzite reacționează cu oxigenul din aer..
Structura chimică
În imaginea superioară este reprezentată structura 1-butenei. În stânga sa puteți vedea locația dublei legături între primul și al doilea carbon. Molecula are o structură liniară, deși regiunea din jurul legăturii C = C este plană datorită hibridizării spDouă dintre acești carboni.
Dacă molecula de 1-butenă ar fi rotită la un unghi de 180º, ar avea aceeași moleculă fără modificări aparente, prin urmare, nu are activitate optică.
Cum ar interacționa moleculele sale? Legăturile C-H, C = C și C-C sunt de natură apolară, deci niciuna dintre ele nu colaborează la formarea unui moment dipolar. În consecință, moleculele CHDouă= CHCHDouăCH3 trebuie să interacționeze prin intermediul forțelor de dispersie din Londra.
Capătul drept al butenei formează dipoli instantanei, care la o distanță mică polarizează atomii adiacenți ai unei molecule vecine. La rândul său, capătul stâng al legăturii C = C interacționează prin suprapunerea norilor π unul peste altul (cum ar fi două napolitane sau foi).
Deoarece există patru atomi de carbon care alcătuiesc scheletul molecular, interacțiunile lor sunt abia suficiente pentru ca faza lichidă să aibă un punct de fierbere de -6ºC..
Izomeri constituționali și geometrici
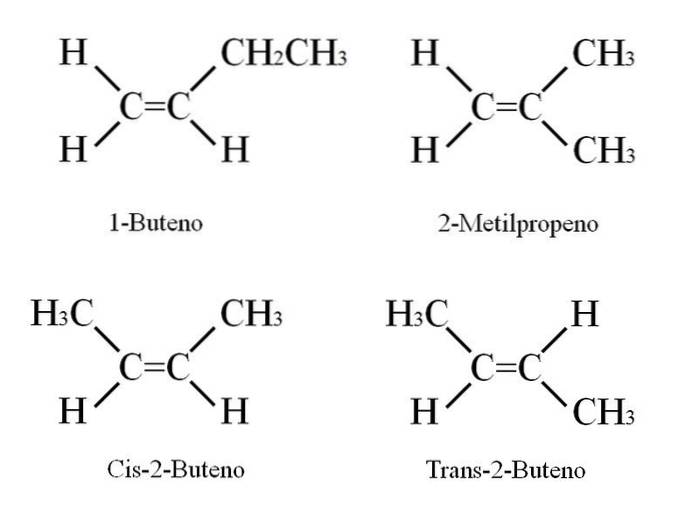
1-Butena are formula moleculară C4H8; Cu toate acestea, alți compuși pot avea aceeași proporție de atomi de C și H în structura lor..
Cum este posibil? Dacă structura 1-butenei este atent observată, substituenții pe carbonii C = C pot fi schimbați. Acest schimb produce alți compuși din același schelet. În plus, poziția dublei legături între C-1 și C-2 se poate deplasa spre C-2 și C-3: CH3CH = CHCH3, 2-Butene.
În 2-butenă atomii de H pot fi localizați pe aceeași parte a legăturii duble, care corespunde stereoizomerului cis; sau într-o orientare spațială opusă, în stereoizomerul trans. Ambii alcătuiesc ceea ce sunt, de asemenea, cunoscuți ca izomeri geometrici. Același lucru este valabil și pentru grupurile -CH3.
De asemenea, rețineți că dacă ar fi lăsat în molecula CH3CH = CHCH3 atomii de H pe o parte și grupurile CH3 în altul, s-ar obține un izomer constituțional: CHDouă= C (CH3)Două, 2-metilpropenă (cunoscută și sub numele de izo-butenă).
Acești patru compuși au aceeași formulă C4H8 dar structuri diferite. 1-butena și 2-metilpropena sunt izomeri constituționali; și cis și trans-2-butenă, izomeri geometrici între ei doi (și constituționali în raport cu restul).
Stabilitate
Căldura de ardere
Din imaginea de mai sus, care dintre cei patru izomeri reprezintă structura cea mai stabilă? Răspunsul poate fi găsit, de exemplu, în căldurile de ardere ale fiecăruia dintre ele. Prin reacția cu oxigenul, izomerul cu formula C4H8 se transformă în CODouă eliberând apă și căldură:
C4H8(g) + 6ODouă(g) => 4CODouă(g) + 4HDouăO (g)
Arderea este exotermă, deci cu cât este eliberată mai multă căldură, cu atât hidrocarbura este mai instabilă. Prin urmare, unul dintre cei patru izomeri care eliberează cea mai mică căldură atunci când arde în aer va fi cel mai stabil..
Căldurile de ardere pentru cei patru izomeri sunt:
-1-butenă: 2717 kJ / mol
-cis-2-butenă: 2710 kJ / mol
-trans-2-butenă: 2707 kJ / mol
-2-metilpropenă: 2700 kJ / mol
Rețineți că 2-metilpropena este izomerul care degajă cea mai mică căldură. În timp ce 1-butena este cea care eliberează mai multă căldură, ceea ce se traduce printr-o instabilitate mai mare.
Efect steric și electronic
Această diferență de stabilitate între izomeri poate fi dedusă direct din structura chimică. Conform alchenelor, cel care are mai mulți substituenți R dobândește o stabilizare mai mare a dublei sale legături. Astfel, 1-butena este cea mai instabilă, deoarece are cu greu un substituent (-CHDouăCH3); adică este monosubstituit (RHC = CHDouă).
Izomerii cis și trans ai 2-butenei diferă ca energie datorită stresului Van der Wall cauzat de efectul steric. În izomerul cis, cele două grupuri CH3 pe aceeași parte a legăturii duble se resping reciproc, în timp ce în izomerul trans, sunt suficient de departe unul de celălalt.
Dar de ce atunci 2-metilpropena este cel mai stabil izomer? Deoarece efectul electronic intercede.
În acest caz, chiar dacă este o alchenă disubstituită, cele două grupări CH3 sunt pe același carbon; în poziție geminală una față de cealaltă. Aceste grupuri stabilizează carbonul legăturii duble, oferindu-i o parte din norul său de electroni (deoarece este relativ mai acid datorită hibridizării sp).Două).
Mai mult, în 2-butenă, cei doi izomeri ai săi au numai 2 ° carboni; în timp ce 2-metilpropena conține un al treilea carbon, cu o stabilitate electronică mai mare.
Forte intermoleculare
Stabilitatea celor patru izomeri urmează o ordine logică, dar forțele intermoleculare nu. Dacă punctele lor de topire și fierbere sunt comparate, se va constata că nu respectă aceeași ordine.
Ar fi de așteptat ca trans-2-butena să prezinte cele mai mari forțe intermoleculare datorită contactului de suprafață mai mare între două molecule, spre deosebire de cis-2-butenă, al cărei schelet atrage un C. Cu toate acestea, cis-2-butena fierbe la temperaturi mai ridicate. (3,7ºC), decât izomerul trans (0,96ºC).
Puncte de fierbere similare pentru 1-butenă și 2-metilpropenă ar fi de așteptat, deoarece sunt foarte similare din punct de vedere structural. Cu toate acestea, în stare solidă diferența se schimbă radical. 1-butena se topește la -185,3ºC, în timp ce 2-metilpropena la -140,4ºC.
În plus, izomerul cis-2-butenă se topește la -138,9ºC, la o temperatură foarte apropiată de 2-metilpropenom, ceea ce poate însemna că în solid prezintă un aranjament la fel de stabil.
Din aceste date se poate concluziona că, în ciuda cunoașterii celor mai stabile structuri, ele nu aruncă suficientă lumină asupra cunoașterii modului în care forțele intermoleculare funcționează în lichid; și chiar mai mult, în faza solidă a acestor izomeri.
Aplicații
-Butenele, având în vedere căldura lor de ardere, pot fi pur și simplu folosite ca sursă de căldură sau combustibili. Astfel, flacăra de 1-butenă ar fi de așteptat să se încălzească mai mult decât cea a celorlalți izomeri..
-Poate fi folosit ca solvenți organici.
-Acestea servesc drept aditivi pentru creșterea nivelului octanic al benzinei.
-În cadrul sintezei organice, 1-butena participă la producerea altor compuși, cum ar fi: butilen oxid, 2-glutanol, succinimidă și terț-butilmecaptan (folosit pentru a conferi gazului de gătit mirosul său caracteristic). La fel, butadiena (CHDouă= CH-CH = CHDouă), din care se sintetizează cauciucul artificial.
Dincolo de aceste sinteze, diversitatea produselor va depinde de moleculele care se adaugă la dubla legătură. De exemplu, halogenurile de alchil pot fi sintetizate dacă reacționează cu halogeni; alcooli, dacă adaugă apă într-un mediu acid; și esterii terț-butilici dacă adaugă alcooli cu greutate moleculară mică (cum ar fi metanolul).
Referințe
- Francis A. Carey. Chimie organica. Acizi carboxilici. (ediția a șasea, paginile 863-866). Mc Graw Hill.
- Wikipedia. (2018). Butene Luat de pe: es.wikipedia.org
- YPF. (Iulie 2017). Buten ne. [PDF]. Preluat de pe: ypf.com
- William Reusch. (5 mai 2013). Reacții de adiție ale alchenelor. Recuperat de la: 2.chemistry.msu.edu
- PubChem. (2018). 1-Butene. Recuperat de la: pubchem.ncbi.nlm.nih.gov



Nimeni nu a comentat acest articol încă.