
Încălziți formulele date, cum să le calculați și exercițiile rezolvate
căldura cedată este transferul de energie între două corpuri la temperaturi diferite. Cel cu cea mai mare temperatură renunță la căldură celui a cărui temperatură este mai mică. Fie că un corp renunță sau absoarbe căldura, temperatura sau starea sa fizică pot varia în funcție de masa și caracteristicile materialului din care este fabricat..
Un bun exemplu este într-o ceașcă de cafea aburindă. Lingura de metal cu care se agită zahărul se încălzește. Dacă este lăsată în ceașcă suficient de mult timp, cafeaua și o lingură de metal vor ajunge să-și egaleze temperaturile: cafeaua s-a răcit și lingura va fi dat căldură. O parte din căldură va fi trecut în mediu, deoarece sistemul nu este izolat.

Pe măsură ce temperaturile s-au egalat, echilibru termic.
Dacă ați face același test cu o linguriță de plastic, cu siguranță ați observa că nu se încălzește la fel de repede ca și cea metalică, dar în cele din urmă va intra și în echilibru cu cafeaua și tot ce o înconjoară..
Acest lucru se datorează faptului că metalul conduce căldura mai bine decât plasticul. Pe de altă parte, cu siguranță cafeaua produce căldură la un ritm diferit de cel al ciocolatei fierbinți sau altor băuturi. Deci căldura dată sau absorbită de fiecare obiect depinde de ce material sau substanță este făcută..
Indice articol
- 1 În ce constă și formule
- 1.1 Diferența de temperatură ΔT
- 1.2 Căldura specifică și capacitatea termică a unei substanțe
- 2 Cum se calculează?
- 2.1 Calorimetrie
- 3 exerciții rezolvate
- 3.1 Exercițiul 1
- 3.2 Exercițiul 2
- 4 Referințe
În ce constă și formule
Căldura se referă întotdeauna la fluxul sau tranzitul de energie între un obiect și altul, datorită diferenței de temperatură.
De aceea vorbim de căldură transferată sau căldură absorbită, deoarece prin adăugarea sau extragerea căldurii sau energiei într-un fel, este posibil să se modifice temperatura unui element.
Cantitatea de căldură pe care o emană cel mai fierbinte obiect se numește de obicei Q. Această valoare este proporțională cu masa obiectului menționat. Un corp cu o masă mare este capabil să producă mai multă căldură decât altul cu o masă mai mică..
Diferența de temperatură ΔT
Un alt factor important în calcularea căldurii eliberate este diferența de temperatură experimentată de obiectul care eliberează căldura. Se notează ca ΔT și se calculează astfel:
ΔT = TF - Tsau
În cele din urmă, cantitatea de căldură transferată depinde și de natura și caracteristicile obiectului, care sunt rezumate cantitativ într-o constantă numită căldura specifică a materialului, notat ca c.
Deci, în cele din urmă, expresia pentru căldura transferată este următoarea:
Îcedat = - m.c.ΔT
A ceda este simbolizat printr-un semn negativ.
Căldura specifică și capacitatea termică a unei substanțe
Căldura specifică este cantitatea de căldură necesară pentru a crește temperatura de 1 g de substanță cu 1 ° C. Este o proprietate intrinsecă a materialului. Unitățile sale din sistemul internațional sunt: Joule / kg. K (Joule între kilogram x temperatură în grade Kelvin).
Capacitatea de căldură C este un concept legat, dar ușor diferit, deoarece este implicată masa obiectului. Capacitatea de căldură este definită după cum urmează:
C = mc
Unitățile sale din S.I. ei sunt Joule / K. Deci căldura degajată poate fi exprimată și în mod echivalent ca:
Q = -C. ΔT
Cum se calculează?
Pentru a calcula căldura degajată de un obiect, este necesar să cunoașteți următoarele:
- Căldura specifică a substanței care renunță la căldură.
- Masa substanței menționate
- Temperatura finală de obținut
Valorile de căldură specifice pentru multe materiale au fost determinate experimental și sunt disponibile în tabele.
Calorimetrie
Acum, dacă această valoare nu este cunoscută, este posibil să o obțineți cu ajutorul unui termometru și a apei într-un recipient izolat termic: calorimetrul. O diagramă a acestui dispozitiv este prezentată în figura care însoțește exercițiul 1.
O probă de substanță la o anumită temperatură este scufundată într-o cantitate de apă măsurată anterior. Se măsoară temperatura finală și se determină căldura specifică a materialului cu valorile obținute..
Prin compararea rezultatului cu valorile tabelate, se poate ști ce substanță este. Această procedură se numește calorimetrie.
Echilibrul termic este realizat prin conservarea energiei:
Î cedat + Î absorbit = 0
Exerciții rezolvate
Exercitiul 1
O bucată de cupru de 0,35 kg este introdusă la o temperatură de 150 ° C în 500 mL de apă la o temperatură de 25 ° C. Găsiți:
a) Temperatura de echilibru final
b) Cât de multă căldură curge în acest proces?
Date
ccupru = 385 J / kg. ºC
capă = 4180 J / kg. ºC
Densitatea apei: 1000 kg / m3
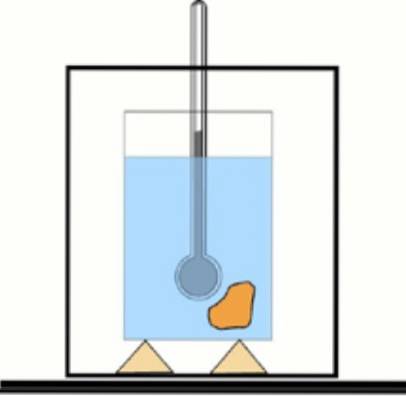
Soluţie
a) Cuprul renunță la căldură în timp ce apa o absoarbe. Deoarece sistemul este considerat închis, numai apa și proba intervin în echilibrul de căldură:
Î cedat = Î absorbit
Pe de altă parte, este necesar să se calculeze masa de 500 ml de apă:
500 mL = 0,5 L = 0,0005 m3
Cu aceste date se calculează masa apei:
masă = densitate x volum = 1000 kg / m3 . 0,0005 m3 = 0,5 kg
Ecuația pentru căldura din fiecare substanță este ridicată:
Îcedat = -mcupru . ccupru. ΔT = -0,35 kg. 385 J / kg ° C . (TF -150 ºC) = -134,75 (TF - 150) J
Îabsorbit = mApă . cApă. ΔT = 0,5 kg. 4186 J / kg. ºC. (TF -25 ºC) = 2093 (TF -25) J
Echivalând rezultatele, avem:
2093 (TF - 25) = -134,75 (TF - 150)
Este o ecuație liniară cu o necunoscută, a cărei soluție este:
TF = 32,56 ºC
b) Cantitatea de căldură care curge este căldura transferată sau căldura absorbită:
Î cedat = - 134,75 (32,56 - 150) J = 15823 J
Î absorbit = 2093 (32,56 - 25) J = 15823 J
Exercițiul 2
O bucată de cupru de 100 g este încălzită într-un cuptor la temperatura Tsau și apoi este introdus într-un calorimetru de cupru de 150 g conținând 200 g de apă la 16 ° C. Temperatura finală o dată în echilibru este de 38 ° C. Când calorimetrul și conținutul său sunt cântărite, se constată că au evaporat 1,2 g de apă Ce a fost temperatura inițială Tsau?
Date: căldura latentă de vaporizare a apei este Lv = 2257 kJ / kg
Soluţie
Acest exercițiu diferă de cel anterior, deoarece trebuie considerat că și calorimetrul absoarbe căldura. Căldura eliberată de bucata de cupru este investită în toate următoarele:
- Încălziți apa din calorimetru (200 g)
- Încălziți cuprul din care este fabricat calorimetrul (150 g)
- Evaporați 1,2 grame de apă (energia este necesară și pentru o schimbare de fază).
Îcedat = -100 X 1 x 10 -3 kg. 385 J / kg. ºC. (38 - Tsau ) ºC = -38,5. (38 - Tsau) J
Î absorbit de calorimetru = Î absorbit de apă + Î vaporizare + Î absorbit de cupru
0,2 kg .4186 J / kg ºC. (38 - 16 ºC) + 1,2 x 10-3 kg. 2257000 J / kg +0,150 kg .385 J / kg .ºC. (38 - 16 ºC) =
18418,4 +2708,4 + 1270,5 J = 22397,3 J
Prin urmare:
-38,5. (38 - Tsau) = 22397,3
Tsau = 619,7 ºC
Căldura necesară pentru a aduce 1,2 g de apă până la 100 ° C ar fi putut fi luată în considerare, dar este o cantitate destul de mică în comparație..
Referințe
- Giancoli, D. 2006. Fizică: principii cu aplicații. 6a. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fizica: O privire asupra lumii. 6ta Ediție scurtată. Cengage Learning. 156 - 164.
- Rex, A. 2011. Fundamentele fizicii. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fizică universitară cu fizică modernă. 14a. Ed. Volumul 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentele fizicii. 9n / A Cengage Learning.


Nimeni nu a comentat acest articol încă.