
Istoria calorimetrului, piesele, tipurile și caracteristicile acestora
calorimetru este un dispozitiv utilizat pentru măsurarea modificării temperaturii unei cantități de substanță (de obicei apă) cu căldură specifică cunoscută. Această modificare a temperaturii se datorează căldurii absorbite sau eliberate în procesul studiat; chimic dacă este o reacție sau fizic dacă constă dintr-o schimbare de fază sau de stare.
În laborator, cel mai simplu calorimetru care poate fi găsit este cel al paharului de cafea. Se folosește pentru a măsura căldura absorbită sau eliberată într-o reacție la presiune constantă, în soluție apoasă. Reacțiile sunt selectate pentru a evita intervenția reactivilor sau a produselor gazoase.
Cantitatea de căldură degajată în reacție = cantitatea de căldură absorbită de calorimetru + cantitatea de căldură absorbită de soluție
Cantitatea de căldură absorbită de calorimetru se numește capacitatea calorimetrică a calorimetrului. Acest lucru este determinat de furnizarea unei cantități cunoscute de căldură calorimetrului cu o masă dată de apă. Apoi, creșterea temperaturii calorimetrului și a soluției care conține.
Cu aceste date și cu utilizarea căldurii specifice a apei (4,18 J / g.ºC), se poate calcula capacitatea calorică a calorimetrului. Această capacitate se mai numește constantă calorimetrică.
Pe de altă parte, căldura obținută de soluția apoasă este egală cu m · ce · Δt. În formula m = masa de apă, ce = căldura specifică a apei și Δt = variația temperaturii. Știind toate acestea, puteți calcula apoi cantitatea de căldură degajată de reacția exotermă.
Indice articol
- 1 Istoricul calorimetrului
- 2 părți
- 3 Tipuri și caracteristicile lor
- 3.1 Paharul de cafea
- 3.2 Bomba calorimetrică
- 3.3 Calorimetrul adiabatic
- 3.4 Calorimetrul izoperibol
- 3.5 Calorimetrul de curgere
- 3.6 Calorimetrul pentru calorimetrie cu scanare diferențială
- 4 Aplicații
- 4.1 În fizico-chimie
- 4.2 În sistemele biologice
- 4.3 Calorimetrul pompei de oxigen și puterea calorică
- 5 Referințe
Istoria calorimetrului
În 1780, A. L. Lavoisier, chimist francez, considerat unul dintre părinții chimiei, a folosit un cobai pentru a măsura producția de căldură prin respirația sa.
Cum? Folosind un dispozitiv similar cu un calorimetru. Căldura produsă de cobai a fost evidențiată prin topirea zăpezii care înconjura aparatul.
Cercetătorii A. L Lavoisier (1743-1794) și P. S. Laplace (1749-1827) au proiectat un calorimetru care a fost utilizat pentru a măsura căldura specifică a unui corp prin metoda topirii gheții..
Calorimetrul consta dintr-o ceașcă cilindrică de tablă lăcuită, susținută de un trepied și terminată intern cu o pâlnie. În interiorul acestuia, a fost așezat un alt pahar, similar cu cel anterior, cu un tub care traversa camera exterioară și care a fost prevăzut cu o cheie. În interiorul celui de-al doilea pahar era o grilă.
Ființa sau obiectul a cărui căldură specifică urma să fie determinată a fost plasat pe această rețea. Gheața era așezată în paharele concentrice, ca în coș.
Căldura produsă de corp a fost absorbită de gheață, provocând topirea acesteia. Și produsul lichid al apei din topirea gheții a fost colectat, deschizând robinetul de sticlă intern.
Și, în cele din urmă, apa a cântărit, s-a cunoscut masa gheții topite.
Părți
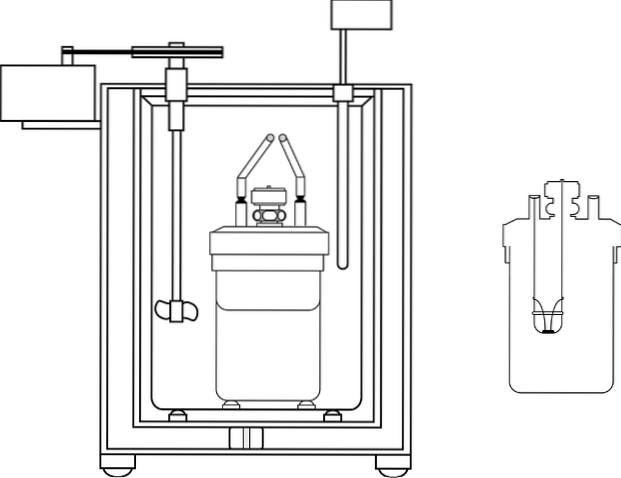
Cel mai utilizat calorimetru în laboratoarele de predare a chimiei este așa-numitul calorimetru cu ceașcă de cafea. Acest calorimetru constă dintr-un pahar sau, în schimb, un recipient de material anime care are anumite proprietăți izolante. În interiorul acestui recipient soluția apoasă este plasată cu corpul care va produce sau absorbi căldura.
Un capac din material izolant cu două găuri este plasat pe partea superioară a recipientului. Într-una se introduce un termometru pentru a măsura schimbările de temperatură, iar în cealaltă un agitator, preferabil din material de sticlă, care îndeplinește funcția de a muta conținutul soluției apoase..
Imaginea prezintă părțile unui calorimetru bombă; Cu toate acestea, se poate vedea că are termometrul și agitatorul, elemente comune în mai multe calorimetre.
Tipuri și caracteristicile acestora
Ceașca de cafea
Este cea care este utilizată în determinarea căldurii eliberate de o reacție exotermă și a căldurii absorbite într-o reacție endotermă..
Mai mult, poate fi folosit la determinarea căldurii specifice unui corp; adică cantitatea de căldură pe care un gram din substanță trebuie să o absoarbă pentru a-și crește temperatura cu un grad Celsius. .
Bomba calorimetrică
Este un dispozitiv în care se măsoară cantitatea de căldură care se degajă sau se absoarbe într-o reacție care are loc la un volum constant.
Reacția are loc într-un recipient robust din oțel (pompa), care este scufundat într-un volum mare de apă. Acest lucru menține modificările mici ale temperaturii apei. Prin urmare, se presupune că modificările asociate reacției sunt măsurate la volum și temperatură constante..
Cele de mai sus indică faptul că nu se lucrează când se efectuează o reacție într-un calorimetru bombă.
Reacția începe prin furnizarea de energie electrică prin cabluri conectate la pompă.
Calorimetrul adiabatic
Se caracterizează prin faptul că are o structură izolatoare numită scut. Scutul este situat în jurul celulei unde apar schimbări de căldură și temperatură. La fel, este conectat la un sistem electronic care își menține temperatura foarte aproape de celulă, pentru a evita transferul de căldură..
Într-un calorimetru adiabatic, diferența de temperatură dintre calorimetru și împrejurimile sale este redusă la minimum; precum și minimizarea coeficientului de transfer de căldură și a timpului pentru schimbul de căldură.
Părțile sale constau din următoarele:
-Celula (sau recipientul), integrată într-un sistem de izolație prin intermediul căreia încearcă să evite pierderile de căldură.
-Termometrul, pentru a măsura schimbările de temperatură.
-Un încălzitor, conectat la o sursă controlabilă de tensiune electrică.
-Și scutul, deja menționat.
În acest tip de calorimetru, se pot determina proprietăți precum entropia, temperatura Debye și densitatea electronilor de stare..
Calorimetrul izoperibol
Este un dispozitiv în care celula de reacție și pompa sunt scufundate într-o structură numită sacou. În acest caz, așa-numitul sacou este format din apă, menținută la o temperatură constantă.
Temperatura celulei și a pompei crește pe măsură ce se eliberează căldură în timpul procesului de ardere; dar temperatura învelișului de apă este menținută la o temperatură fixă.
Un microprocesor controlează temperatura celulei și a învelișului, făcând corecțiile necesare pentru căldura de scurgere care rezultă din diferențele dintre cele două temperaturi..
Aceste corecții sunt aplicate continuu și cu o corecție finală, pe baza măsurătorilor înainte și după test..
Calorimetrul de curgere
Dezvoltat de Caliendar, are un dispozitiv pentru a muta un gaz într-un container la o viteză constantă. Prin adăugarea căldurii, se măsoară creșterea temperaturii în fluid.
Calorimetrul de curgere se caracterizează prin:
- O măsurare precisă a vitezei debitului constant.
- Măsurarea exactă a cantității de căldură introdusă în fluid printr-un încălzitor.
- O măsurare precisă a creșterii temperaturii în gaz cauzată de aportul de energie
- Un design pentru măsurarea capacității unui gaz sub presiune.
Calorimetrul pentru calorimetrie de scanare diferențială
Se caracterizează prin faptul că are două recipiente: într-unul se plasează proba care urmează să fie studiată, în timp ce celălalt este păstrat gol sau se folosește un material de referință..
Cele două vase sunt încălzite la o rată constantă de energie, prin intermediul a două încălzitoare independente. Când cele două vase încep să se încălzească, computerul va calcula diferența de flux de căldură de la încălzitoare în raport cu temperatura, permițând astfel determinarea fluxului de căldură..
Mai mult, variația temperaturii în funcție de timp poate fi determinată; și în cele din urmă, capacitatea calorică.
Aplicații
În fizico-chimie
-Calorimetrele de bază, tip ceașcă de cafea, permit măsurarea cantității de căldură pe care un corp o degajă sau o absoarbe. În ele este posibil să se determine dacă o reacție este exotermă sau endotermă. În plus, poate fi determinată căldura specifică a unui corp.
-Cu calorimetrul adiabatic a fost posibil să se determine entropia unui proces chimic și densitatea electronică a stării.
În sistemele biologice
-Microcalorimetrele sunt utilizate pentru a studia sistemele biologice care includ interacțiuni între molecule, precum și modificările conformaționale moleculare care apar; de exemplu, în desfășurarea unei molecule. Linia include atât măturarea diferențială, cât și titrarea izotermă.
-Microcorimetrul este utilizat în dezvoltarea de medicamente cu molecule mici, bioterapie și vaccinuri.
Calorimetrul pompei de oxigen și puterea calorică
În calorimetrul cu bombă de oxigen are loc arderea a numeroase substanțe, iar valoarea calorică a acestuia poate fi determinată. Printre substanțele studiate folosind acest calorimetru se numără: cărbune și cocs; uleiuri comestibile, atât grele, cât și ușoare; benzina si toti combustibilii auto.
La fel și tipurile de combustibili pentru reactoarele de aeronave; deșeuri de combustibil și eliminarea deșeurilor; produse alimentare și suplimente pentru hrana umană; culturi furajere și suplimente pentru hrana animalelor; Materiale de construcție; combustibili pentru rachete și propulsori.
De asemenea, puterea calorică a fost determinată prin calorimetrie în studiile termodinamice ale materialelor combustibile; în studiul echilibrului energetic în ecologie; în explozivi și pulberi termice și în predarea metodelor termodinamice de bază.
Referințe
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- González J., Cortés L. și Sánchez A. (s.f.). Calorimetria adiabatică și aplicațiile sale. Recuperat de la: cenam.mx
- Wikipedia. (2018). Calorimetru. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (22 iunie 2018). Definiția calorimetrului în chimie. Recuperat de pe: thoughtco.com
- Gillespie, Claire. (11 aprilie 2018). Cum funcționează un calorimetru? Știința. Recuperat de pe: sciencing.com


Nimeni nu a comentat acest articol încă.