
Proprietăți, structură, utilizări, riscuri ale oxalatului de calciu (CaC2O4)
oxalat de calciu Este un compus organic format din elementele carbon (C), oxigen (O) și calciu (Ca). Formula sa chimică este CaCDouăSAU4. În general, se găsește în cele trei forme hidratate: mono-, di- și trihidrat. Adică, cu una, două sau trei molecule de apă, respectiv, în structura sa cristalină..
Oxalatul de calciu se găsește în minerale, plante, ciuperci și alte ființe vii, cum ar fi mamiferele și chiar la oameni, ca o consecință a metabolismului unor proteine. Poate fi găsit în urina oamenilor și a unor animale.
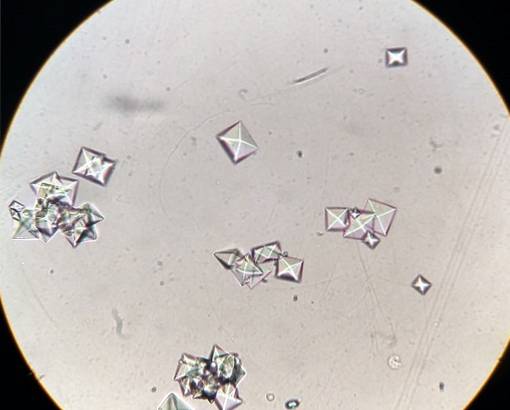
Unele alimente precum spanacul, rubarba, soia și ciocolata conțin o mulțime de oxalați, iar atunci când persoanele sensibile le mănâncă, se pot forma pietre de oxalat de calciu în rinichi..
Pietrele CaC pot fi preveniteDouăSAU4 în rinichi dacă ingeră multe lichide, în special apă, evitând alimentele bogate în oxalați și consumând cele bogate în calciu și magneziu.
Oxalatul de calciu formează cantități nedorite în țevi și rezervoare în procese precum fabricarea celulozei și hârtiei, precum și în fabricile de bere.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Greutate specifică
- 3.5 Solubilitate
- 3,6 pH
- 3.7 Proprietăți chimice
- 4 Prezență în natură
- 4.1 În minerale
- 4.2 La plante și ciuperci
- 5 Prezența în corpul uman și în mamifere
- 5.1 La om
- 5.2 Factori care afectează aspectul pietrelor la rinichi
- 5.3 Modalități de evitare a formării de pietre de oxalat de calciu
- 5.4 La animale
- 5.5 Răspunsul corpului la excesul de oxalat
- 6 utilizări
- 6.1 Probleme în unele procese
- 7 Riscuri
- 8 Referințe
Structura
Oxalatul de calciu este format din ionul de calciu CaDouă+ iar ionul oxalat CDouăSAU4Două-. Anionul oxalat este format din doi atomi de carbon și patru atomi de oxigen. Sarcinile negative ale anionului oxalat se găsesc pe atomii de oxigen.
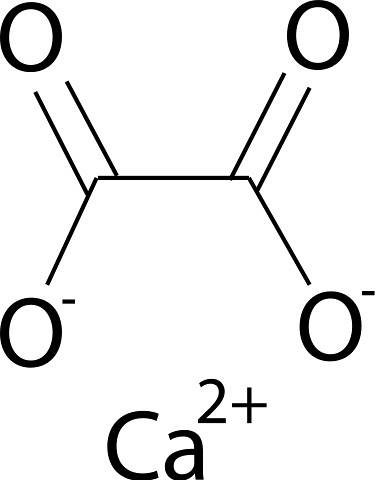
Nomenclatură
- Oxalat de calciu
- Sare de calciu a acidului oxalic
- Sarea de calciu a acidului etandiodic
Proprietăți
Starea fizică
Solid cristalin incolor, alb, galben sau maro, care poate fi sub trei forme diferite hidratate.
Greutate moleculară
128,1 g / mol
Punct de topire
Oxalatul de calciu monohidrat se descompune la 200 ° C.
Greutate specifică
CaC monohidratDouăSAU4 •HDouăO = 2,22 g / cm3
Dihidrat CaCDouăSAU4 •2HDouăO = 1,94 g / cm3
Trihidrat CaCDouăSAU4 •3HDouăO = 1,87 g / cm3
Solubilitate
Aproape insolubil în apă: 0,00061 g / 100 g apă la 20 ° C. Monohidratul se dizolvă în acid diluat.
pH
Soluțiile apoase de oxalat de calciu sunt slab bazice.
Proprietăți chimice
Oxalatul de calciu este sarea de calciu a acidului oxalic. Acesta este un produs secundar natural al metabolismului, deci este foarte abundent în corpul uman și face parte din multe alimente.
Acidul oxalic și baza sa conjugată, oxalatul, sunt compuși organici foarte oxidați, cu o puternică activitate de chelare, adică se pot combina cu ușurință cu ioni pozitivi cu sarcini de +2 sau +3.
Soluțiile sale apoase sunt slab bazice, deoarece ionul oxalat tinde să preia protoni H.+ din apă, care eliberează ioni OH-. După ce a luat doi protoni H+ ionul oxalat devine acid oxalic HDouăCDouăSAU4:
CDouăSAU4Două- + HDouăO → HCDouăSAU4- + Oh-
HCDouăSAU4- + HDouăO → HDouăCDouăSAU4 + Oh-
Prezență în natură
În minerale
Oxalatul de calciu este cel mai frecvent oxalat și se prezintă sub formă de minerale prin satelit, weddellite și caoxit..
Whewellite este CaC monohidratDouăSAU4 •HDouăSau este cea mai stabilă dintre formele acestui compus.

Weddellite este CaC dihidratDouăSAU4 •2HDouăO și este mai puțin stabil decât monohidratul.

Caoxitul este oxalat de calciu trihidrat CaCDouăSAU4 •3HDouăSAU.
La plante și ciuperci
Oxalatul de calciu se găsește asociat cu soluri și frunze uscate, de asemenea cu ciuperci patogene, libere, în simbioză sau asociate plantelor. În acesta din urmă, cristalele se formează prin precipitarea calciului sub forma oxalatului său..
Formarea CaCDouăSAU4 de ciuperci are o influență importantă asupra proceselor biologice și geochimice ale solurilor, deoarece constituie o rezervă de calciu pentru ecosistem.
Prezență în corpul uman și în mamifere
Oxalatul provine din ficat, din celulele roșii din sânge sau eritrocite și, într-o măsură mai mică, în rinichi. Se formează din metabolismul aminoacizilor (cum ar fi fenilalanina și triptofanul) și prin oxidarea dialdehidei glioxale,.
De asemenea, vitamina C poate fi transformată în oxalat atunci când își îndeplinește funcția antioxidantă.
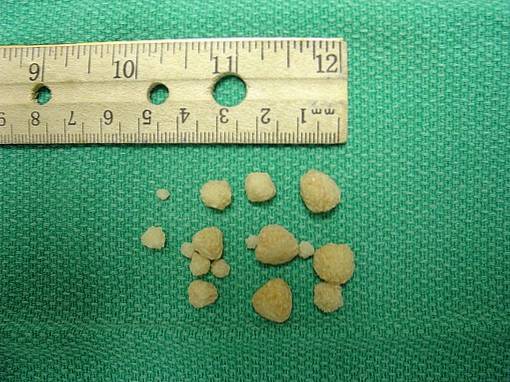
Oxalatul de calciu se găsește în pietre care se formează în rinichii persoanelor sau animalelor cu boli de rinichi..
Așa-numitele pietre de oxalat de calciu sau pietre se formează prin cristalizarea sau agregarea CaCDouăSAU4 în urină suprasaturată cu calciu și oxalat. Aceasta înseamnă că urina conține atât de mult calciu și oxalat încât nu este posibil ca acest compus să rămână dizolvat, ci mai degrabă să precipite sau să treacă la starea solidă sub formă de cristale..
În oameni
Formarea de sâmburii sau pietre la rinichi este o boală numită nefrolitiază; atacă aproximativ 10% din populație și aproximativ 75% din aceste pietre sunt compuse din oxalat de calciu CaCDouăSAU4.
Formarea și creșterea cristalelor de oxalat de calciu în rinichi au loc deoarece la unii oameni urina este suprasaturată cu această sare. Oxalatul de calciu se dezvoltă în urină acidă la pH mai mic de 6,0.
Suprasaturarea apare atunci când excreția sau eliminarea acestei sări (care este foarte puțin solubilă în apă) în urină are loc într-un volum mic de apă..
Factori care afectează apariția pietrelor la rinichi
Printre factorii care favorizează formarea granulatului de oxalat de calciu se numără excesul de calciu în urină sau hipercalciuria, excesul de oxalat în urină sau hiperoxaluria, elemente derivate din dietă și absența inhibitorilor.
Excesul de oxalat poate apărea atunci când se consumă cantități mari de spanac, rubarbă, soia, nuci și ciocolată, printre alte alimente..

Cu toate acestea, există substanțe care inhibă sau previn formarea pietrei. Compușii care împiedică formarea pietrei includ molecule mici, cum ar fi citrat și pirofosfat, și molecule mari, cum ar fi glicoproteine și proteoglicani..
Modalități de evitare a formării de pietre de oxalat de calciu
O strategie bună pentru a preveni reapariția pietrelor de granulație sau oxalat de calciu include creșterea aportului de lichide, creșterea aportului de alimente bogate în calciu (cum ar fi lactatele) și restricționarea sării de masă (NaCl), a proteinelor animale și a alimentelor bogate în oxalat.
La animale
De la începutul anului 2000, s-a observat o creștere a calculilor cu oxalat de calciu în sistemul urinar al pisicilor și câinilor. Se pare că acest lucru depinde de tipul de dietă pe care îl consumă aceste animale și are legătură cu aciditatea deficitului de urină și magneziu (Mg).
Răspunsul corpului la excesul de oxalat
Există dovezi că atât oamenii, cât și animalele răspund la excesul de oxalat prin creșterea numărului de bacterii care pot descompune oxalatul..
Unele dintre aceste bacterii sunt Oxigenele formigene, Bifidobacterium sp., Porphyromonas gingivalis Da Bacillus sp., printre altele și sunt prezente în mod natural în intestin.
Aplicații
Potrivit surselor consultate, oxalatul de calciu este utilizat în acoperirea ceramică.
A fost folosit pentru acoperirea sculpturilor de calcar și a altor elemente artistice și s-a constatat că îmbunătățește duritatea materialului, scade porozitatea acestuia și își mărește rezistența la acizi și alcali..

Probleme în unele procese
În industria celulozei și hârtiei, oxalatul de calciu poate forma scară, ceea ce cauzează multe probleme în proces..
Pentru a preveni formarea acestuia în conductele sau conductele proceselor industriale, a fost propusă degradarea enzimatică a acidului oxalic, prin intermediul enzimelor precum oxalat oxidaza..
De asemenea, tinde să se acumuleze ca piatra în recipientele unde se face berea, de unde trebuie eliminată pentru a evita formarea de microorganisme care pot da un gust neplăcut băuturii..
Riscuri
În concentrații mari, oxalatul poate provoca moartea la animale și ocazional la oameni, în principal datorită efectelor sale corozive..
Acumularea de oxalat și acidul conjugat al acestuia, acidul oxalic, poate provoca tulburări precum disfuncții cardiace, calculi cu oxalat de calciu, insuficiență renală și chiar moarte din cauza toxicității.
Referințe
- Glasauer, S.M. și colab. (2013). Metale și metaloizi, transformarea de către microorganisme. Oxalați. În modulul de referință în sistemele pământului și științele mediului. Recuperat de la sciencedirect.com.
- Baumann, J. M. și Casella, R. (2019). Prevenirea nefrolitiazei de calciu: influența diurezei asupra cristalizării oxalatului de calciu în urină. Adv Prev Med, 2019; 2019: 3234867. Recuperat de la ncbi.nlm.nih.gov.
- Breshears, M.A. și Confer, A.W. (2017). Sistemul urinar. Calculi oxalat de calciu. În baza patologică a bolilor veterinare (ediția a șasea). Recuperat de la sciencedirect.com.
- Huang, Y. er al. (2019). Manipularea oxalatului în corpul și originea oxalatului în pietrele de oxalat de calciu. Urol Int, 2019 5 decembrie: 1-10. Recuperat de la ncbi.nlm.nih.gov.
- Nilvebrant, N.-O. și colab. (2002). Biotehnologia în industria celulozei și a hârtiei. În progres în biotehnologie. Recuperat de la sciencedirect.com.
- Pahira, J.J. și Pevzner, M. (2007). Nefrolitiaza. Pietre de calciu. În Penn Clinical Manual of Urology. Recuperat de la sciencedirect.com.
- Worcester, E. M. (1994). Inhibitori de creștere a cristalelor de oxalat de calciu urinar. J Am Soc Nephrol 1994 nov; 5 (5 Supliment 1): S46-53). Recuperat de la jasn.asnjournals.org.
- Finkielstein, V.A. și Goldfarb, D.S. (2006). Strategii pentru prevenirea calculilor cu oxalat de calciu. Recuperat de la ncbi.nlm.nih.gov.
- S.U.A. Biblioteca Națională de Medicină. (2019). Oxalat de calciu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Peck, A.B. și colab. (2015). Microorganisme care degradează oxalatul sau enzime care degradează oxalatul: care este terapia viitoare pentru dizolvarea enzimatică a urolitilor de oxalat de calciu în boala recurentă a pietrei? Urolitiaza, februarie 2016; 44 (1): 27-32. Recuperat de la ncbi.nlm.nih.gov.
- Holames, R.P. și colab. (2016). Scăderea excreției de oxalat urinar pentru scăderea bolii de calciu a oxalatului de calciu. Urolitiaza. 2016 februarie; 44 (1); 27-32. Recuperat de la ncbi.nlm.nih.gov.
- Cezar, T.M. (1998). Oxalat de calciu: un tratament de suprafață pentru calcar. Journal of Conservation and Museum Studies 4, pp. 6-10. Recuperat de la jcms-journal.com.
- Wikimedia (2019). Oxalat de calciu. Recuperat de pe en.wikipedia.org.



Nimeni nu a comentat acest articol încă.