
Structura, proprietățile, utilizările și sinteza ciclobutanului

ciclobutan este o hidrocarbură formată dintr-un cicloalcan cu patru carbon, a cărui formulă moleculară este C4H8. Poate fi numit și tetrametilenă, având în vedere că sunt patru unități CHDouă care alcătuiesc un inel cu geometrie pătrată, deși numele de ciclobutan este mai acceptat și mai cunoscut.
La temperatura camerei este un gaz incolor, inflamabil, care arde cu o flacără puternică. Utilizarea sa cea mai primitivă este ca sursă de căldură atunci când o arde; Cu toate acestea, baza sa structurală (pătratul) cuprinde aspecte biologice și chimice profunde și colaborează într-un anumit mod cu proprietățile acestor compuși..
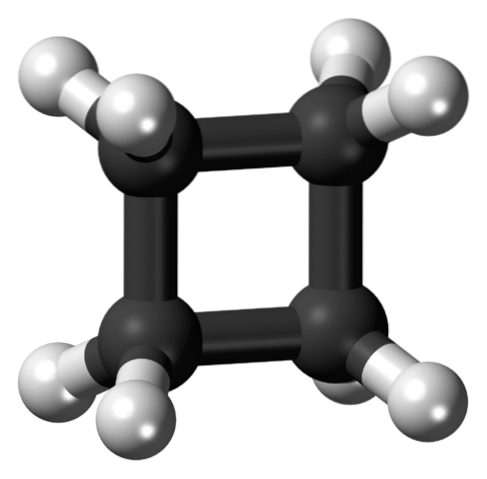
Imaginea superioară arată o moleculă de ciclobutan cu o structură pătrată. În secțiunea următoare vom explica de ce această conformație este instabilă, deoarece legăturile sale sunt tensionate..
După ciclopropan, acesta este cel mai instabil cicloalcan, întrucât cu cât dimensiunea inelului este mai mică, cu atât va fi mai reactiv. Conform acestui fapt, ciclobutanul este mai instabil decât ciclurile pentanului și hexanului. Cu toate acestea, este curios să asistăm în derivatele sale la un nucleu sau o inimă pătrată, care, după cum se va vedea, este dinamică.
Indice articol
- 1 Structura ciclobutanului
- 1.1 Conformații fluture sau ridate
- 1.2 Interacțiuni intermoleculare
- 2 Proprietăți
- 2.1 Aspect fizic
- 2.2 Masa moleculară
- 2.3 Punctul de fierbere
- 2.4 Punct de topire
- 2.5 Punct de aprindere
- 2.6 Solubilitate
- 2.7 Densitate
- 2.8 Densitatea vaporilor
- 2.9 Presiunea vaporilor
- 2.10 Indicele de refracție
- 2.11 Entalpia de ardere
- 2.12 Căldura de formare
- 3 Sinteza
- 4 utilizări
- 5 Referințe
Structura ciclobutanului
În prima imagine, structura ciclobutanului a fost abordată ca un simplu pătrat carbonizat și hidrogenat. Cu toate acestea, în acest pătrat perfect orbitalii suferă o răsucire severă față de unghiurile lor inițiale: sunt separați de un unghi de 90º comparativ cu 109,5º pentru un atom de carbon cu hibridizare sp.3 (stres unghiular).
Atomi de carbon sp3 acestea sunt tetraedrice și pentru unele tetraedre ar fi dificil să se flexeze orbitalele atât de mult pentru a crea un unghi de 90 °; dar ar fi și mai mult pentru carbonii cu hibridizări spDouă (120º) și sp (180º) deviază unghiurile originale. Din acest motiv ciclobutanul are atomi de carbon sp3 în esență.
De asemenea, atomii de hidrogen sunt foarte apropiați unul de celălalt, eclipsați în spațiu. Acest lucru are ca rezultat o creștere a obstacolelor sterice, care slăbește pătratul presupus datorită stresului său torsional ridicat..
Prin urmare, solicitările unghiulare și de torsiune (încapsulate în termenul „solicitare inelară”) fac această conformație instabilă în condiții normale..
Molecula de ciclobutan va căuta să reducă ambele solicitări și, pentru a realiza acest lucru, adoptă ceea ce este cunoscut sub numele de fluture sau conformație îndoită..
Conformații fluture sau ridate
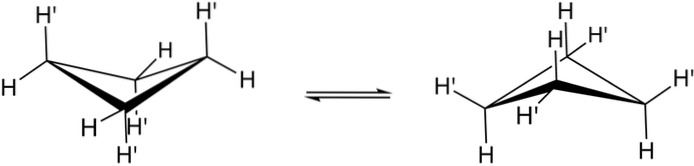
Adevăratele conformații ale ciclobutanului sunt prezentate mai sus. În ele, tensiunile unghiulare și torsionale scad; întrucât, după cum se poate observa, acum nu toți atomii de hidrogen sunt eclipsați. Cu toate acestea, există un cost energetic: unghiul legăturilor sale este ascuțit, adică scade de la 90 la 88º.
Rețineți că poate fi comparat cu un fluture, ale cărui aripi triunghiulare sunt formate din trei atomi de carbon; iar al patrulea, poziționat la un unghi de 25 ° față de fiecare aripă. Săgețile în două sensuri indică faptul că există un echilibru între ambii conformatori. Este ca și cum fluturele a coborât și și-a ridicat aripile.
La derivații ciclobutanici, pe de altă parte, se va aștepta ca această clătire să fie mult mai lentă și împiedicată spațial..
Interacțiuni intermoleculare
Să presupunem că uitați de pătrate pentru o clipă și că sunt înlocuite cu fluturi carbogazoși. Acestea din flapping-ul lor pot fi ținute împreună în lichid de către forțele de dispersie londoneze, care sunt proporționale cu aria aripilor și masa lor moleculară..
Proprietăți
Aspectul fizic
Gaz incolor.
Masa moleculara
56,107 g / mol.
Punct de fierbere
12,6 ° C. Prin urmare, în condiții de frig, ar putea fi manipulat, în principiu, ca orice lichid; cu singurul detaliu, că ar fi extrem de volatil, iar vaporii săi ar reprezenta în continuare un risc de luat în considerare.
Punct de topire
-91ºC.
punctul de aprindere
50ºC sticlă închisă.
Solubilitate
Insolubil în apă, ceea ce nu este surprinzător având în vedere natura sa nepolare; dar este ușor solubil în alcooli, eter și acetonă, care sunt solvenți mai puțin polari. Se așteaptă să fie solubil (deși nu este raportat) logic în solvenți apolari precum tetraclorură de carbon, benzen, xilen etc..
Densitate
0,7125 la 5 ° C (în raport cu 1 din apă).
Densitatea vaporilor
1,93 (în raport cu 1 din aer). Aceasta înseamnă că este mai dens decât aerul și, prin urmare, dacă nu există curenți, tendința sa nu va fi de a crește..
Presiunea de vapori
1.180 mmHg la 25 ° C.
Indicele de refracție
1,3625 la 290ºC.
Entalpia de ardere
-655,9 kJ / mol.
Căldura de formare
6,6 Kcal / mol la 25ºC.
Sinteză
Ciclobutanul este sintetizat prin hidrogenarea ciclobutadienei, a cărei structură este aproape aceeași, cu singura diferență că are o legătură dublă; și, prin urmare, este și mai reactiv. Aceasta este poate cea mai simplă cale sintetică pentru a o obține, sau cel puțin numai pentru aceasta și nu pentru un derivat.
În țițeiul este puțin probabil să-l obțină, deoarece ar ajunge să reacționeze în așa fel încât să rupă inelul și să formeze lanțul liniar, adică n-butan..
O altă metodă de obținere a ciclobutanului constă în lovirea radiației ultraviolete pe moleculele de etilenă, CHDouă= CHDouă, care se dimerizează. Această reacție este favorizată fotochimic, dar nu termodinamic:
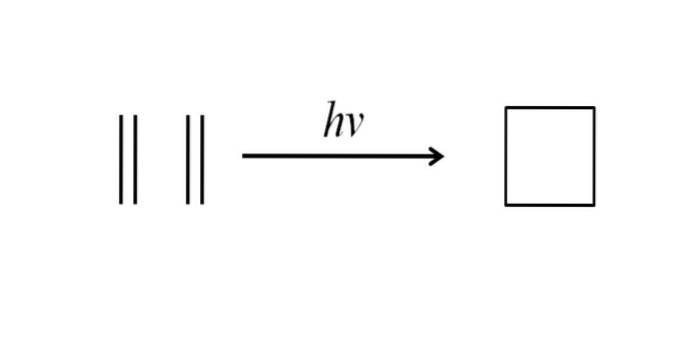
Imaginea de mai sus rezumă foarte bine cele spuse în paragraful de mai sus. Dacă în loc de etilenă s-ar avea, de exemplu, oricare două alchene, s-ar obține un ciclobutan substituit; sau ceea ce este același, un derivat al ciclobutanului. De fapt, mulți derivați cu structuri interesante au fost sintetizați prin această metodă..
Cu toate acestea, alți derivați implică o serie de etape sintetice complicate. Prin urmare, ciclobutanii (așa cum se numesc derivații lor) fac obiectul studiului pentru sinteze organice..
Aplicații
Ciclobutanul singur nu are altă utilizare decât să servească drept sursă de căldură; dar, derivații săi, intră pe teren complicat în sinteza organică, cu aplicații în farmacologie, biotehnologie și medicină. Fără a intra în structuri excesiv de complexe, penitremele și grandisolul sunt exemple de ciclobutani.
Ciclobutanii au, în general, proprietăți care sunt benefice pentru metabolismul bacteriilor, plantelor, nevertebratelor marine și ciupercilor. Acestea sunt active din punct de vedere biologic și de aceea utilizările lor sunt foarte variate și dificil de specificat, deoarece fiecare are efectul său special asupra anumitor organisme..
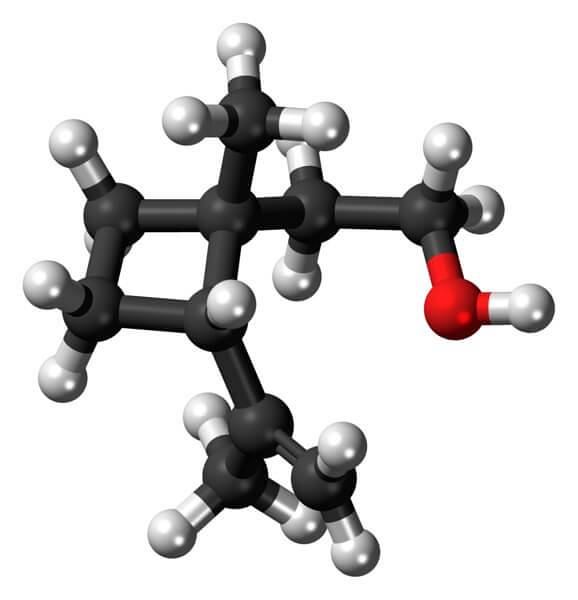
Grandisol, de exemplu, este un feromon de la gărgăriță (un tip de gândac). Deasupra și, în cele din urmă, este prezentată structura sa, considerată un monoterpen cu o bază pătrată de ciclobutan.
Referințe
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons, T.W.; Craig B. Fryhle. (2011). Chimie organica. (unsprezecea ediție). Wiley.
- Wikipedia. (2019). Ciclobutan. Recuperat de pe: en.wikipedia.org
- PubChem. (2019). Ciclobutan. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015, 29 noiembrie). Proprietățile fizice ale cicloalcanilor. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Proprietăți ciclobutan-fizice și studii teoretice. Departamentul de Chimie, Universitatea Yale.
- Klement Foo. (s.f.). Ciclobutanii în sinteza organică. Recuperat de la: scripps.edu
- Myers. (s.f.). Sinteza ciclobutanilor. Chem 115. Recuperat de la: hwpi.harvard.edu



Nimeni nu a comentat acest articol încă.