
Structura, proprietățile și utilizările ciclopentanului (C5H10)
ciclopentan este o hidrocarbură ciclică, mai precis un cicloalcan. La rândul său, este un compus organic a cărui formulă moleculară este C5H10. Poate fi văzut ca versiunea închisă a n-pentan, lanț deschis, în care capetele sale au fost unite prin pierderea a doi atomi de hidrogen.
Imaginea inferioară arată scheletul ciclopentanului. Observați cât de geometric arată scheletul său, formând un inel pentagonal. Cu toate acestea, structura sa moleculară nu este plană, ci prezintă mai degrabă pliuri care caută să stabilizeze și să reducă stresul din inel. Ciclopentanul este un lichid extrem de volatil și inflamabil, dar nu la fel de inflamabil ca n-pentan.
Datorită capacității sale de solvent, ciclopentanul este unul dintre cei mai utilizați solvenți în industria chimică. Nu este surprinzător faptul că multe produse cu mirosuri puternice îl conțin printre compoziția lor, fiind deci inflamabile. De asemenea, este utilizat ca agent de suflare pentru spumele poliuretanice utilizate în frigidere..
Indice articol
- 1 Structura ciclipentanului
- 1.1 Interacțiuni intermoleculare
- 1.2 Conformații și solicitări inelare
- 2 Proprietățile ciclipentanului
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Punctul de topire
- 2.4 Punctul de fierbere
- 2.5 Punct de aprindere
- 2.6 Temperatura de autoinflamare
- 2.7 Căldura de vaporizare
- 2.8 Vâscozitatea
- 2.9 Indicele de refracție
- 2.10 Presiunea vaporilor
- 2.11 Densitatea
- 2.12 Solubilitate
- 2.13 Coeficientul de partiție octanol / apă
- 2.14 Reactivitate
- 3 utilizări
- 3.1 Solvent industrial
- 3.2 Sursă de etilenă
- 3.3 Izolarea spumelor poliuretanice
- 4 Referințe
Structura ciclipentanului
Interacțiuni intermoleculare
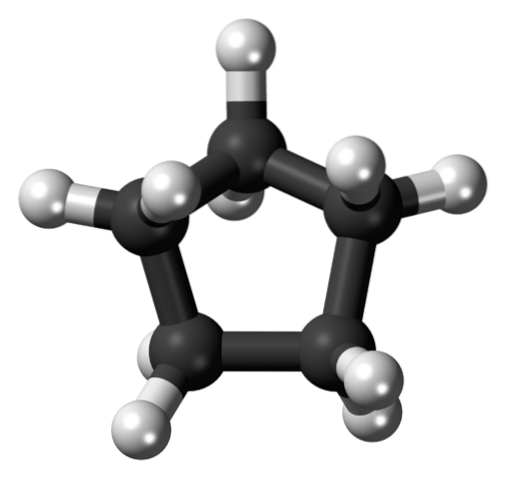
În prima imagine a fost prezentat scheletul ciclopentanului. Mai sus vedem acum că este mai mult decât un simplu pentagon: atomii de hidrogen (sfere albe) ies în afară, în timp ce atomii de carbon alcătuiesc inelul pentagonal (sfere negre).
Având doar legături C-C și C-H, momentul dipolului lor este neglijabil, astfel încât moleculele ciclopentane nu pot interacționa între ele prin forțe dipol-dipol. În schimb, ele sunt ținute împreună datorită forțelor dispersive ale Londrei, cu inelele care încearcă să se adune unul peste celălalt..
Această stivuire oferă o zonă de contact mai mare decât cea disponibilă între moleculele liniare de n-pentan. Ca urmare, ciclopentanul are un punct de fierbere mai mare decât n-pentan, precum și o presiune mai mică a vaporilor.
Forțele dispersive sunt responsabile de ciclopentan care formează un cristal molecular atunci când este înghețat la -94 ° C. Deși nu există prea multe informații cu privire la structura sa cristalină, este polimorfă și are trei faze: I, II și III, faza II fiind un amestec dezordonat de I și III.
Conformații și solicitări inelare
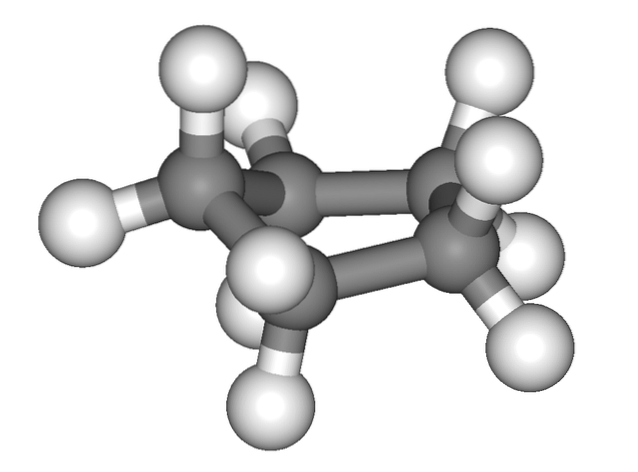
Imaginea de mai sus dă falsa impresie că ciclopentanul este plat; dar nu este așa. Toți atomii săi de carbon au hibridizare sp3, deci orbitalele lor nu se află în același plan. De asemenea, ca și când acest lucru nu ar fi suficient, atomii de hidrogen sunt foarte apropiați unul de altul, puternic respinși atunci când sunt eclipsați..
Astfel, vorbim de conformații, una dintre ele fiind jumătatea scaunului (imaginea de sus). Din această perspectivă, se apreciază clar că inelul ciclopentan are îndoiri, care ajută la reducerea tensiunii inelului datorită atomilor de carbon atât de apropiați unul de celălalt..
Această tensiune se datorează faptului că legăturile C-C prezintă unghiuri mai mici de 109,5º, valoarea ideală pentru mediul tetraedric ca urmare a hibridizărilor lor sp.3.
Cu toate acestea, în ciuda acestui stres, ciclopentanul este un compus mai stabil și mai puțin inflamabil decât pentanul. Acest lucru poate fi verificat comparând diamantele lor de siguranță, în care inflamabilitatea ciclopentanului este 3, în timp ce cea a pentanului, 4.
Proprietățile ciclipentanului
Aspectul fizic
Lichid incolor cu un miros ușor asemănător petrolului.
Masă molară
70,1 g / mol
Punct de topire
-93,9 ºC
Punct de fierbere
49,2 ºC
Punct de aprindere
-37,2 ºC
temperatură de autoaprindere
361 ºC
Căldura de vaporizare
28,52 kJ / mol la 25 ° C
Viscozitate
0,413 mPa s
Indicele de refracție
1.4065
Presiunea de vapori
45 kPa la 20 ° C. Această presiune corespunde cu aproximativ 440 atm, cu toate acestea mai mică decât cea a n-Pentan: 57,90 kPa.
Aici se manifestă efectul structurii: inelul ciclopentan permite interacțiuni intermoleculare mai eficiente, care leagă și își păstrează mai mult moleculele în lichid în comparație cu moleculele liniare ale n-pentan. Prin urmare, acesta din urmă are o presiune de vapori mai mare.
Densitate
0,751 g / cm3 la 20 ° C. Pe de altă parte, vaporii săi sunt de 2,42 ori mai densi decât aerul.
Solubilitate
Într-un litru de apă la 25 ° C, numai 156 mg de ciclopentan se dizolvă, datorită naturii sale hidrofobe. Cu toate acestea, este miscibil în solvenți nepolari precum alte parafine, eteri, benzen, tetraclorură de carbon, acetonă și etanol..
Coeficientul de partiție octanol / apă
3
Reactivitate
Ciclopentanul este stabil atunci când este depozitat corespunzător. Nu este o substanță reactivă, deoarece legăturile sale C-H și C-C nu sunt ușor de rupt, chiar dacă ar duce la eliberarea de energie cauzată de tensiunea inelului.
În prezența oxigenului, acesta va arde într-o reacție de ardere, fie că este completă sau incompletă. Deoarece ciclopentanul este un compus foarte volatil, acesta trebuie depozitat în locuri unde nu poate fi expus la nicio sursă de căldură..
Între timp, în absența oxigenului, ciclopentanul va suferi o reacție de piroliză, descompunându-se în molecule mai mici și nesaturate. Una dintre ele este 1-pentena, care arată că căldura rupe inelul ciclopentan pentru a produce o alchenă.
Pe de altă parte, ciclopentanul poate reacționa cu bromul sub radiații ultraviolete. În acest fel, una dintre legăturile sale C-H este înlocuită cu C-Br, care la rândul său poate fi înlocuită cu alte grupuri; și, astfel, apar derivați de ciclopentan.
Aplicații
Solvent industrial
Caracterul hidrofob și apolar al ciclopentanului îl face un solvent degresant, alături de alți solvenți parafini. Datorită acestui fapt, este de obicei parte a formulărilor multor produse, cum ar fi lipici, rășini sintetice, vopsele, adezivi, tutun și benzină..
Sursă de etilenă
Când ciclopentanul este supus pirolizei, una dintre cele mai importante substanțe pe care le generează este etilena, care are nenumărate aplicații în lumea polimerilor..
Spume izolante din poliuretan
Una dintre cele mai notabile utilizări ale ciclopentanului este ca agent de suflare pentru fabricarea spumelor poliuretanice izolante; adică vaporii de ciclopentan, datorită presiunii lor ridicate, extind materialul polimeric până când formează o spumă cu proprietăți benefice pentru a fi utilizată în cadrul frigiderelor sau congelatoarelor.
Unele companii au ales să înlocuiască HFC cu ciclopentan în fabricarea materialelor izolante, deoarece nu contribuie la deteriorarea stratului de ozon și, de asemenea, reduce eliberarea de gaze cu efect de seră în mediu.
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. (10a ediție.). Wiley plus.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Wikipedia. (2020). Ciclopentan. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2020). Ciclopentan. Baza de date PubChem, CID = 9253. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Ciclopentan. ScienceDirect. Recuperat de pe: sciencedirect.com
- Electrocasnice GE. (2011, 11 ianuarie). Reducerea emisiilor de gaze cu efect de seră la instalațiile de producere a frigiderelor GE. Recuperat de la: pressroom.geappliances.com

Nimeni nu a comentat acest articol încă.