
Istoria acidului acetic, structura, proprietăți, utilizări
acid acetic sau acidul etanoic este un lichid organic incolor a cărui formulă chimică este CH3COOH. Când este dizolvat în apă, se obține un bine cunoscut amestec numit oțet, care a fost folosit ca aditiv în alimente de mult timp. Oțetul este o soluție apoasă de acid acetic cu o concentrație de aproximativ 5%.
După cum indică și numele, este un compus acid și, prin urmare, oțetul are valori ale pH-ului mai mici de 7. În prezența sării sale acetat, acesta constituie un sistem tampon care este eficient în reglarea pH-ului între 2,76 și 6,76; adică menține pH-ul în acest interval cu adăugări moderate de o bază sau un acid.

Formula sa este suficientă pentru a realiza că este formată prin unirea unei grupări metil (CH3) și o grupare carboxil (COOH). După acidul formic, HCOOH, este unul dintre cei mai simpli acizi organici; care reprezintă, de asemenea, punctul final al multor procese de fermentare.
Astfel, acidul acetic poate fi produs prin fermentare bacteriană aerobă și anaerobă și prin sinteză chimică, procesul de carbonilare a metanolului fiind principalul mecanism de producție al acestuia..
Pe lângă utilizarea zilnică ca sos de salată, în industrie reprezintă materia primă pentru producerea acetatului de celuloză, un polimer care este utilizat pentru realizarea filmelor fotografice. În plus, acidul acetic este utilizat în sinteza acetatului de polivinil, utilizat pentru a face un adeziv pentru lemn..
Când oțetul a devenit foarte concentrat, nu mai este numit ca atare și se numește acid acetic glacial. La aceste concentrații, chiar dacă este un acid slab, este foarte coroziv și poate provoca iritații ale pielii și ale căilor respiratorii doar prin respirație superficială. Acidul acetic glacial găsește utilizarea ca solvent în sinteze organice.
Indice articol
- 1 Istorie
- 1.1 1800
- 1.2 1900
- 2 Structura acidului acetic
- 3 Proprietăți fizice și chimice
- 3.1 Denumiri chimice
- 3.2 Formula moleculară
- 3.3 Aspect fizic
- 3.4 Miros
- 3.5 Aromă
- 3.6 Punctul de fierbere
- 3.7 Punct de topire
- 3.8 Punct de aprindere
- 3.9 Solubilitate în apă
- 3.10 Solubilitate în solvenți organici
- 3.11 Densitate
- 3.12 Densitatea vaporilor
- 3.13 Presiunea vaporilor
- 3.14 Descompunerea
- 3.15 Vâscozitatea
- 3.16 Corozivitate
- 3.17 Căldura de ardere
- 3.18 Căldura de vaporizare
- 3,19 pH
- 3.20 Tensiunea superficială
- 3,21 pKa
- 3.22 Reacții chimice
- 4 Producție
- 4.1 Fermentarea oxidativă sau aerobă
- 4.2 Fermentarea anaerobă
- 4.3 Carbonilarea metanolului
- 4.4 Oxidarea acetaldehidei
- 5 utilizări
- 5.1 Industrial
- 5.2 Ca solvent
- 5.3 Medici
- 5.4 În alimente
- 6 Referințe
Poveste
Omul aparținând numeroaselor culturi, a folosit fermentarea a numeroase fructe, leguminoase, cereale etc. pentru a obține băuturi alcoolice, produs al transformării zaharurilor, precum glucoza, în etanol, CH3CHDouăOh.
Probabil pentru că metoda inițială de producere a alcoolului și a oțetului este fermentarea, probabil încercarea de a produce alcool într-un moment nedeterminat, cu multe secole în urmă, oțetul a fost obținut din greșeală. Rețineți asemănarea dintre formulele chimice ale acidului acetic și etanol.
Încă din secolul al III-lea î.Hr., filosoful grec Theophastus a descris acțiunea oțetului asupra metalelor pentru producerea de pigmenți, cum ar fi albul de plumb.
1800
În 1823, un echipament în formă de turn a fost proiectat în Germania pentru fermentarea aerobă a diferitelor produse, în scopul obținerii acidului acetic sub formă de oțet..
În 1846, Herman Foelbe a realizat mai întâi sinteza acidului acetic prin utilizarea compușilor anorganici. Sinteza a început cu clorurarea disulfurii de carbon și s-a încheiat, după două reacții, cu o reducere electrolitică la acid acetic.
La sfârșitul secolului al XIX-lea și începutul secolului al XX-lea, datorită cercetărilor lui J. Weizmann, bacteria Clostridium acetobutylicum a început să fie folosită pentru producerea acidului acetic, prin fermentație anaerobă..
1900
La începutul secolului al XX-lea, tehnologia dominantă a fost producerea de acid acetic prin oxidarea acetaldehidei.
În 1925, Henry Dreyfus de la compania britanică Celanese, a proiectat o fabrică pilot pentru carbonilarea metanolului. Mai târziu, în 1963, compania germană BASF a introdus utilizarea cobaltului ca catalizator.
Otto Hromatka și Heinrich Ebner (1949), au proiectat un rezervor cu un sistem de agitare și alimentare cu aer pentru fermentarea aerobă, destinat producției de oțet. Acest instrument, cu unele adaptări, este încă în uz.
În 1970, compania nord-americană Montsanto a folosit un sistem de catalizator pe bază de rodiu pentru carbonilarea metanolului..
Ulterior, compania BP, în 1990, a introdus procesul Cativa cu utilizarea catalizatorului iridiu în același scop. Această metodă sa dovedit a fi mai eficientă și mai puțin agresivă din punct de vedere ecologic decât metoda Montsanto..
Structura acidului acetic
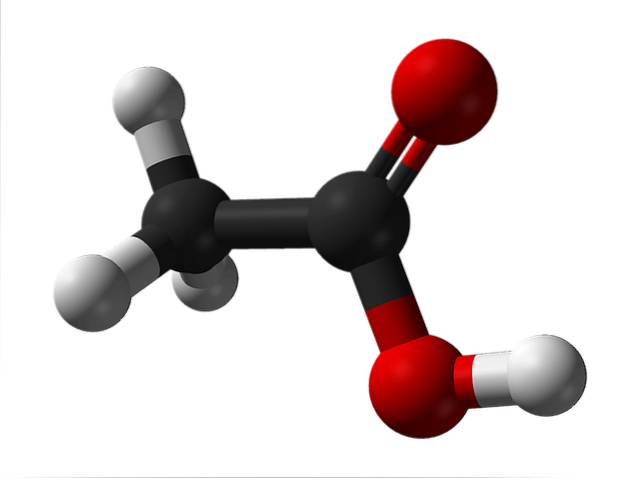
Imaginea superioară arată structura acidului acetic reprezentată cu un model de sfere și bare. Sferele roșii corespund atomilor de oxigen, care la rândul lor aparțin grupei carboxil, -COOH. Prin urmare, este un acid carboxilic. În partea dreaptă a structurii se află gruparea metil, -CH3.
După cum se poate vedea, este o moleculă foarte mică și simplă. Prezintă un moment dipol permanent datorat grupului -COOH, care permite, de asemenea, acidului acetic să formeze două legături de hidrogen consecutiv.
Aceste punți sunt cele care orientează spațial moleculele CH.3COOH pentru a forma dimeri în stare lichidă (și gazoasă).

Deasupra în imagine puteți vedea cum cele două molecule sunt aranjate pentru a forma cele două legături de hidrogen: O-H-O și O-H-O. Pentru evaporarea acidului acetic, trebuie furnizată suficientă energie pentru a rupe aceste interacțiuni; motiv pentru care este un lichid cu un punct de fierbere mai mare decât cel al apei (aproximativ 118 ° C).
Proprietati fizice si chimice
Denumiri chimice
Acid:
-Acetic
-Etanoic
-Etil
Formulă moleculară
CDouăH4SAUDouă sau CH3COOH.
Aspectul fizic
Lichid incolor.
Miros
Acru caracteristic.
Gust
Ardere.
Punct de fierbere
244ºF până la 760mmHg (117,9ºC).
Punct de topire
61,9 ºF (16,6 ºC).
punctul de aprindere
112ºF (cupă deschisă) 104ºF (cupă închisă).
Solubilitatea apei
106 mg / mL la 25 ° C (este miscibil în toate proporțiile).
Solubilitate în solvenți organici
Este solubil în etanol, eter etilic, acetonă și benzen. De asemenea, este solubil în tetraclorură de carbon.
Densitate
1,051 g / cm3 la 68ºF (1.044 g / cm3 la 25 ° C).
Densitatea vaporilor
2,07 (relativ la aer = 1).
Presiunea de vapori
15,7 mmHg la 25 ° C.
Descompunere
Când este încălzit la peste 440 ºC, se descompune pentru a produce dioxid de carbon și metan.
Viscozitate
1.056 mPascal la 25 ° C.
Corozivitate
Acidul acetic glacial este extrem de coroziv și ingestia acestuia poate provoca leziuni severe ale esofagului și pilorului la om..
Căldura de ardere
874,2 kJ / mol.
Căldura de vaporizare
23,70 kJ / mol la 117,9 ºC.
23,36 kJ / mol la 25,0 ºC.
pH
-O soluție de concentrație 1 M are un pH de 2,4
- Pentru o soluție 0,1M, pH-ul său este de 2,9
- Și 3.4 dacă soluția este 0,01M
Tensiune de suprafata
27,10 mN / m la 25 ° C.
pKa
4,76 la 25 ° C.
Reacții chimice
Acidul acetic este coroziv pentru multe metale, eliberând H gazDouă și formând săruri metalice numite acetați. Cu excepția acetatului de crom (II), acetații sunt solubili în apă. Reacția sa cu magneziu este reprezentată de următoarea ecuație chimică:
Mg (s) + 2 CH3COOH (ag) => (CH3GÂNGURI)DouăMg (ag) + HDouă (g)
Prin reducere acidul acetic formează etanol. De asemenea, poate forma anhidridă acetică din pierderea de apă din două molecule de apă..
Producție
După cum sa menționat anterior, fermentația produce acid acetic. Această fermentație poate fi aerobă (în prezența oxigenului) sau anaerobă (fără oxigen).
Fermentarea oxidativă sau aerobă
Bacteriile din genul Acetobacter pot acționa asupra etanolului sau alcoolului etilic, provocând oxidarea acestuia în acid acetic sub formă de oțet. Prin această metodă, se poate produce oțet cu o concentrație de 20% acid acetic..
Aceste bacterii sunt capabile să producă oțet, acționând asupra unei game largi de intrări care includ diferite fructe, leguminoase fermentate, malț, cereale precum orezul sau alte legume care conțin sau pot produce alcool etilic..
Reacția chimică facilitată de bacteriile din genul Acetobacter este după cum urmează:
CH3CHDouăOH + ODouă => CH3COOH + HDouăSAU
Fermentarea oxidativă se efectuează în rezervoare cu agitație mecanică și aport de oxigen..
Fermentarea anaerobă
Se bazează pe capacitatea unor bacterii de a produce acid acetic acționând direct asupra zaharurilor, fără a necesita substanțe intermediare pentru producerea acidului acetic..
C6H12SAU6 => 3CH3COOH
Bacteria care intervine în acest proces este Clostridium acetobutylicum, care este capabilă să intervină în sinteza altor compuși, pe lângă acidul acetic..
Bacteriile acetogene pot produce acid acetic, acționând asupra moleculelor formate dintr-un singur atom de carbon; acesta este cazul metanolului și monoxidului de carbon.
Fermentarea anaerobă este mai puțin costisitoare decât fermentarea oxidativă, dar are limitarea că bacteriile din genul Clostridium nu sunt foarte rezistente la aciditate. Acest lucru îi limitează capacitatea de a produce oțet cu o concentrație mare de acid acetic, cum se obține în fermentația oxidativă..
Carbonilarea metanolului
Metanolul poate reacționa cu monoxidul de carbon pentru a produce acid acetic în prezența catalizatorilor
CH3OH + CO => CH3COOH
Folosind iodometanul ca catalizator, carbonilarea metanolului are loc în trei etape:
Într-o primă etapă, acidul hidroiodic (HI) reacționează cu metanolul, producând iodometan, care reacționează într-o a doua etapă cu monoxidul de carbon, formând compusul iodo acetaldehidă (CH3COI). Apoi, CH3COI hidratează pentru a produce acid acetic și a regenera HI.
Procesul Monsanto (1966) este o metodă pentru fabricarea acidului acetic prin carbonilare catalitică a metanolului. Este dezvoltat la o presiune de 30 până la 60 atm, la o temperatură de 150 - 200 ºC și utilizând un sistem de catalizator de rodiu..
Procesul Monsanto a fost în mare parte înlocuit de procesul Cativa (1990) dezvoltat de BP Chemicals LTD, care utilizează un catalizator de iridiu. Acest proces este mai ieftin și mai puțin poluant.
Oxidarea acetaldehidei
Această oxidare necesită catalizatori metalici precum naftenați, săruri de mangan, cobalt sau crom..
2 CH3CHO + ODouă => 2 CH3COOH
Oxidarea acetaldehidei poate avea un randament foarte mare care poate ajunge la 95% cu catalizatori adecvați. Produsele secundare ale reacției sunt separate de acid acetic prin distilare.
După metoda de carbonilare a metanolului, oxidarea acetaldehidei este a doua formă în procent de producție industrială de acid acetic.
Aplicații
Industrial
-Acidul acetic reacționează cu etilena în prezența oxigenului pentru a forma monomer de acetat de vinil, folosind paladiu ca catalizator de reacție. Acetat de vinil polimerizează în acetat de polivinil, care este utilizat ca component în vopsele și materiale adezive..
-Reacționează cu diferiți alcooli pentru a produce esteri, inclusiv acetat de etil și acetat de propil. Esterii acetatului sunt folosiți ca solvenți pentru cerneluri, nitroceluloză, acoperiri, lacuri și lacuri acrilice..
-Prin condensarea a două molecule de acid acetic, pierderea unei molecule a unei molecule, anhidridă acetică, CH3CO-O-COCH3. Acest compus este implicat în sinteza acetatului de celuloză, un polimer care constituie o țesătură sintetică și este utilizat în producția de filme fotografice..
Ca solvent
-Este un solvent polar cu capacitatea de a forma legături de hidrogen. Este capabil să dizolve compuși polari precum săruri anorganice și zaharuri, dar dizolvă și compuși nepolari precum uleiuri și grăsimi. În plus, acidul acetic este miscibil cu solvenții polari și nepolari..
-Miscibilitatea acidului acetic în alcani depinde de extinderea lanțului acestora: pe măsură ce lungimea lanțului de alcani crește, miscibilitatea acestuia cu acidul acetic scade.
Medici
-Acidul acetic diluat este utilizat ca antiseptic, aplicat local, cu capacitatea de a ataca bacterii precum streptococi, stafilococi și pseudomoni. Datorită acestei acțiuni este utilizat în tratamentul infecțiilor cutanate.
-Acidul acetic este utilizat în endoscopia esofagului Barrett. Aceasta este o afecțiune în care mucoasa esofagiană se modifică, devenind similară cu mucoasa intestinului subțire..
-Un gel de acid acetic de 3% pare a fi un adjuvant eficient la tratamentul cu medicamentul vaginal Misoprostol, inducând avortul medical în trimestrul mediu, în special la femeile cu un pH vaginal de 5 sau mai mult..
-Este folosit ca înlocuitor pentru coaja chimică. Cu toate acestea, au apărut complicații cu această utilizare, deoarece a fost raportat cel puțin un caz de arsuri suferite de un pacient.
În mâncare
Oțetul a fost folosit de mult timp ca condiment și aromă în alimente, făcând din aceasta cea mai cunoscută aplicație a acidului acetic..
Referințe
- Byju's. (2018). Ce este acidul etanoic? Recuperat de pe: byjus.com
- PubChem. (2018). Acid acetic. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Acid acetic. Recuperat de pe: en.wikipedia.org
- Carte chimică. (2017). Acid acetic glacial. Recuperat de pe: chemicalbook.com
- Acid acetic: ce este și la ce servește? Recuperat din: acidoacetico.info
- Helmenstine, Anne Marie, dr. (22 iunie 2018). Ce este acidul acetic glacial? Recuperat de pe: thoughtco.com

Nimeni nu a comentat acest articol încă.