
Structura moleculară, proprietăți, utilizări ale cianurii de hidrogen
acid cianhidric sau cianura de hidrogen este un compus organic a cărui formulă chimică este HCN. Este, de asemenea, cunoscut sub numele de metanonitril sau formonitril și, până acum câțiva ani, ca acid prusic, deși acesta este de fapt un alt compus.
Acidul cianhidric este un gaz extrem de otrăvitor, incolor, care se obține prin tratarea cianurilor cu acizi. Acest acid se găsește în semințele de piersici, cunoscute și în multe locuri sub numele de piersici..

La o temperatură ambiantă mai mică de 25 ° C este un lichid și peste această temperatură este un gaz. În ambele cazuri, este extrem de toxic pentru oameni, animale și chiar pentru majoritatea microorganismelor neacclimatate cu acesta. Este un bun solvent pentru ioni. Este foarte instabil, deoarece tinde să se polimerizeze ușor.
Se găsește în regnul vegetal încorporat în moleculele unor glicozide, deoarece atunci când acestea sunt hidrolizate de enzimele plantei, se obțin HCN, glucoză și benzaldehidă..
Aceste glicozide se află în semințele anumitor fructe, cum ar fi piersicile, caisele, cireșele, prunele și migdalele amare, deci nu ar trebui să fie ingerate niciodată..
Se găsește și în glicozide vegetale, cum ar fi unele tipuri de sorg. De asemenea, unele bacterii o produc în timpul metabolismului lor. Este utilizat în principal în producția de polimeri și în unele procese metalurgice.
HCN este o otravă mortală prin inhalare, ingestie și contact. Este prezent în fumul de țigară și în fumul provenit din focurile de materiale plastice și materiale care conțin carbon și azot. Este considerat un poluant atmosferic, deoarece este produs în timpul arderii materialului organic din zone întinse ale planetei.
Indice articol
- 1 Structura moleculară și configurația electronică
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Punct de aprindere
- 3.6 Temperatura de autoaprindere
- 3.7 Densitate
- 3.8 Solubilitate
- 3.9 Constanta de disociere
- 3.10 Unele proprietăți chimice
- 3.11 Corozivitate
- 4 Amplasarea în natură
- 5 utilizări
- 5.1 La prepararea altor compuși chimici și polimeri
- 5.2 Utilizări diverse
- 5.3 În agricultură
- 6 Riscuri
- 6.1 Mecanismul acțiunii letale în corp
- 6.2 Risc de fum de țigară
- 6.3 Riscuri de încălzire HCN
- 6.4 Prezența HCN în fumul de foc
- 6.5 Poluantul aerului
- 7 Referințe
Structura moleculară și configurația electronică
Acidul cianhidric sau cianura de hidrogen este un compus molecular covalent cu un hidrogen, un carbon și un atom de azot..
Atomul de carbon și cel de azot împart 3 perechi de electroni, deci formează o legătură triplă. Hidrogenul este legat de carbon, care cu această legătură prezintă valența sa de patru și octetul său complet de electroni.
Azotul are o valență de cinci și pentru a-și completa octetul are o pereche de electroni nepereche sau solitari localizați lateral.
HCN este deci o moleculă complet liniară, cu o pereche de electroni nepereche localizată lateral în azot..
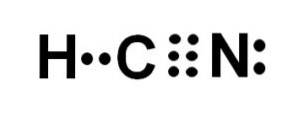
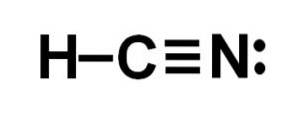
Nomenclatură
- Acid cianhidric
- Acid cianhidric
- Metanonitril
- Formonitril
- Acid cianhidric
Proprietăți
Starea fizică
Sub 25,6 ° C, dacă este anhidru și stabilizat, este un lichid incolor sau albastru pal foarte instabil și toxic. Dacă este peste această temperatură, este un gaz incolor extrem de otrăvitor.
Greutate moleculară
27,03 g / mol
Punct de topire
-13,28 ºC
Punct de fierbere
25,63 ºC (rețineți că fierbe puțin peste temperatura camerei).
Punct de aprindere
-18 ºC (metoda cupei închise)
Temperatură de autoaprindere
538 ºC
Densitate
0,6875 g / cm3 la 20 ° C
Solubilitate
Complet miscibil cu apă, alcool etilic și eter etilic.
Constanta de disociere
K = 2,1 x 10-9
pKla = 9,2 (este un acid foarte slab)
Unele proprietăți chimice
HCN are o constantă dielectrică foarte mare (107-25 ° C). Acest lucru se datorează faptului că moleculele sale sunt foarte polare și se asociază prin legături de hidrogen, ca în cazul apei HDouăSAU.
Datorită constantei sale dielectrice ridicate, HCN se dovedește a fi un bun solvent ionizant..
HCN lichid anhidru este foarte instabil, tinde să se polimerizeze violent. Pentru a evita acest lucru, se adaugă stabilizatori, cum ar fi un procent mic de HDouăSW4.
În soluție apoasă și în prezența amoniacului și a presiunii ridicate, formează adenină, un compus care face parte din ADN și ARN, adică o moleculă importantă din punct de vedere biologic.
Este un acid foarte slab, deoarece constanta sa de ionizare este foarte mică, deci ionizează doar parțial în apă, dând anionului cianură CN-. Formează săruri cu baze dar nu cu carbonați.
Soluțiile sale apoase neprotejate de lumină se descompun generând lent formiat de amoniu HCOONH4.
În soluție are un miros slab de migdale.
Corozivitate
Deoarece este un acid slab, în general nu este coroziv.
Cu toate acestea, soluțiile apoase de HCN care conțin acid sulfuric ca stabilizator atacă puternic oțelul la temperaturi peste 40 ° C și oțelul inoxidabil la temperaturi peste 80 ° C..
În plus, soluțiile apoase diluate de HCN pot provoca stres la oțelul carbon chiar și la temperatura camerei..
De asemenea, poate ataca unele tipuri de cauciucuri, materiale plastice și acoperiri.
Locație în natură
Se găsește relativ abundent în regnul plantelor ca parte a glicozidelor.
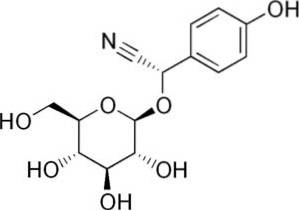
De exemplu, este generat din amigdalina C6H5-CH (-CN) -O-Glucoză-O-Glucoză, un compus prezent în migdalele amare. Amigdalina este un beta-glucozid cianogen, deoarece atunci când este hidrolizat formează două molecule de glucoză, una de benzaldehidă și una de HCN. Enzima care le eliberează este beta-glucoxidaza.
Amigdalina se găsește în semințele de piersici, caise, migdale amare, cireșe și prune..
Unele tipuri de plante de sorg conțin glicozidul cianogen durrin (adică, p-hidroxi- (S) -mandelonitril-beta-D-glucozid). Acest compus poate fi degradat printr-o hidroliză enzimatică în doi pași.
În primul rând, enzima durrinază care este endogenă în plantele de sorg o hidrolizează în glucoză și p-hidroxi- (S) -mandelonitril. Acesta din urmă este apoi transformat rapid în HCN liber și p-hidroxibenzaldehidă.

HCN este responsabil pentru rezistența plantelor de sorg la dăunători și agenți patogeni.
Acest lucru se explică prin faptul că durrina și enzima durrinază au locații diferite în aceste plante și vin în contact numai atunci când țesuturile sunt rănite sau distruse, eliberând HCN și protejând planta de infecții care ar putea pătrunde prin partea rănită..
În plus, unele bacterii patogene umane, cum ar fi Pseudomonas aeruginosa Da P. gingivalis îl produc în timpul activității lor metabolice.
Aplicații
La prepararea altor compuși chimici și polimeri
Utilizarea care implică cea mai mare parte a HCN produsă la nivel industrial este prepararea intermediarilor pentru sinteza organică..
Se utilizează în sinteza adiponitrilului NC- (CHDouă)4-CN, care este folosit pentru fabricarea nailonului sau a nailonului, o poliamidă. Este, de asemenea, utilizat pentru a prepara acrilonitril sau cianoetilenă CHDouă= CH-CN, utilizat pentru prepararea fibrelor acrilice și a materialelor plastice.
Derivatul său de cianură de sodiu NaCN este utilizat pentru recuperarea aurului în exploatarea acestui metal.
Un alt derivat al său, clorura de cianogen ClCN, este utilizat pentru formulele de pesticide.
HCN este utilizat pentru prepararea agenților de chelare, cum ar fi EDTA (etilen-diamină-tetra-acetat).
Este utilizat pentru fabricarea ferocianurilor și a unor produse farmaceutice.
Utilizări diverse
Gazul HCN a fost folosit ca insecticid, fungicid și dezinfectant, pentru fumigarea navelor și clădirilor. De asemenea, pentru a fumiga mobilierul pentru a le restabili.
HCN a fost utilizat în lustruirea metalelor, galvanizarea metalelor, procese fotografice și procese metalurgice..
Datorită toxicității sale ridicate, a fost desemnat agent de război chimic..
În agricultură
A fost folosit ca erbicid și pesticid în livezi. A fost folosit pentru controlul solzilor și altor agenți patogeni de pe citrice, dar unii dintre acești dăunători au devenit rezistenți la HCN.
De asemenea, a fost folosit pentru fumigarea silozurilor de cereale. Gazul HCN preparat la fața locului a fost utilizat în fumigarea boabelor de grâu pentru a le păstra de dăunători precum insecte, ciuperci și rozătoare. Pentru această utilizare este esențial ca semințele care trebuie fumigate să tolereze agentul pesticid..
Testarea s-a făcut prin pulverizarea semințelor de grâu cu HCN și s-a constatat că nu afectează negativ potențialul lor de germinare, ci se pare că îl favorizează..
Cu toate acestea, dozele mari de HCN pot reduce semnificativ lungimea frunzelor mici care răsar din semințe..
Pe de altă parte, datorită faptului că este un nematicid puternic și că unele plante de sorg îl au în țesuturile lor, se investighează potențialul plantelor de sorg de a fi utilizate ca gunoi de grajd verde biocid..
Utilizarea acestuia ar servi la ameliorarea solurilor, suprimarea buruienilor și controlul bolilor și al daunelor cauzate de nematodii fitoparaziți..
Riscuri
Pentru oameni, HCN este o otravă letală pe toate căile: inhalare, ingestie și contact..

Inhalarea poate fi fatală. Se estimează că aproximativ 60-70% din populație poate detecta mirosul de migdale amare al HCN atunci când se află în aer la o concentrație de 1-5 ppm..
Dar există 20% din populație care nu o poate detecta nici măcar la concentrații letale, deoarece este incapabilă genetic să o facă.
Ingerat, este o otravă acută și cu acțiune imediată..
Dacă soluțiile lor vin în contact cu pielea, cianura asociată poate fi letală.
HCN este prezent în fumul de țigară și cel generat atunci când plasticele care conțin azot sunt arse.
Mecanism letal de acțiune în interiorul corpului
Este un asfixiator chimic și este rapid toxic, ducând frecvent la moarte. La intrarea în organism, se leagă de metaloenzime (enzime care conțin un ion metalic), inactivându-le. Este un agent toxic pentru diferite organe ale corpului uman
Principalul său efect toxic constă în inhibarea respirației celulare, deoarece dezactivează o enzimă care influențează fosforilarea în mitocondrii, care sunt organite care intervin, printre altele, în funcția respiratorie a celulelor..
Pericol de fum de țigară
HCN este prezent în fumul de țigară.
Deși mulți oameni cunosc efectul otrăvitor al HCN, puțini oameni își dau seama că sunt expuși efectului său nociv prin fumul de țigară..
HCN este una dintre cauzele inhibării mai multor enzime respiratorii celulare. Cantitatea de HCN prezentă în fumul de țigară are un efect deosebit de dăunător asupra sistemului nervos..
Nivelurile de HCN din fumul de țigară au fost raportate între 10 și 400 μg per țigară pentru fum direct inhalat și 0,006 - 0,27 μg / țigară pentru inhalarea secundară (fum pasiv) HCN produce efecte toxice începând cu 40 μM.

Când este inhalat, acesta intră rapid în fluxul sanguin, unde este eliberat în plasmă sau se leagă de hemoglobină. O mică parte este transformată în tiocianat și este excretată în urină.
Riscuri de încălzire HCN
Expunerea prelungită la căldură a HCN lichid în recipiente închise poate provoca ruperea violentă neașteptată a recipientelor. Poate polimeriza exploziv la 50-60 ° C în prezența urmelor de alcali și în absența inhibitorilor.
Prezența HCN în fumul din incendii
HCN este eliberat în timpul arderii polimerilor care conțin azot, cum ar fi lână, mătase, poliacrilonitril și nailon, printre altele. Aceste materiale sunt prezente în casele noastre și în majoritatea locurilor de activitate umană.
Din acest motiv, în timpul incendiilor HCN poate fi potențial cauza morții prin inhalare..
Poluant al atmosferei
HCN este un poluant al troposferei. Este rezistent la fotoliză și în condițiile ambientale ale atmosferei nu suferă hidroliză.
Radicalii hidroxil OH produși fotochimic pot reacționa cu HCN, dar reacția este foarte lentă, deci timpul de înjumătățire al HCN în atmosferă este de 2 ani.
Când biomasa, în special turbă, este arsă, HCN este eliberat în atmosferă și, de asemenea, în timpul activităților industriale. Cu toate acestea, arderea turbării este de 5 până la 10 ori mai poluantă decât arderea altor tipuri de biomasă.
Unii cercetători au descoperit că temperaturile ridicate și seceta cauzate de fenomenul El Niño în anumite zone ale planetei exacerbează incendiile sezoniere în zonele cu un conținut ridicat de materie vegetală descompusă..

Aceasta duce la arderea intensă a biomasei în anotimpurile secetoase..
Aceste evenimente sunt sursa unor concentrații mari de HCN în troposferă, care sunt transportate în cele din urmă către stratosfera inferioară, rămânând pentru o perioadă foarte lungă de timp..
Referințe
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- S.U.A. Biblioteca Națională de Medicină. (2019). Acid cianhidric. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Cianură de hidrogen - o actualizare. Medicina muncii 2017; 67: 662-663. Recuperat de la ncbi.nlm.nih.gov.
- Enciclopedia științifică a lui Van Nostrand. (2005). Acid cianhidric. 9a Recuperat de la onlinelibrary.wiley.com.
- Ren, Y.-L. și colab. (o mie nouă sute nouăzeci și șase). Efectul cianurii de hidrogen și a sulfurii de carbonil asupra germinării și a vigorii plumulei grâului. Pestice. Sci. 1996, 47, 1-5. Recuperat de la onlinelibrary.wiley.com.
- De la Nicola, G.R. și colab. (2011). O metodă analitică simplă pentru evaluarea conținutului de Dhurrin în plante cianogene pentru utilizarea lor în furaje și biofumigare. J. Agric. Food Chem.2011, 59, 8065-8069. Recuperat de la pubs.acs.org.
- Sheese, P.E. și colab. (2017). O îmbunătățire globală a cianurii de hidrogen în stratosfera inferioară pe tot parcursul anului 2016. Geophys. Res. Lett., 44, 5791-5797. Recuperat de pe agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. și Drochioiu, G. (2013). Vizualizarea pericolului de fumat: o determinare spectrofotometrică simplă a cianurii de hidrogen în fumul de țigară și filtrele. J. Chem. Educ. 2013, 90, 1654-1657. Recuperat de la pubs.acs.org.
- Alarie, Y. și colab. (1990). Rolul cianurii de hidrogen în moartea umană în foc. În foc și polimeri. Capitolul 3. Seria Simpozionului ACS. Recuperat de la pubs.acs.org.



Nimeni nu a comentat acest articol încă.