
Structura acidului azotat (HNO2), proprietăți, sinteză

acid azotat este un acid slab, anorganic, a cărui formulă chimică este HNODouă. Se găsește în principal în soluție apoasă cu o culoare albastru pal. Este foarte instabil și se descompune rapid în oxid nitric, NO și acid azotic, HNO3.
Se găsește de obicei într-o soluție apoasă sub formă de nitriți. De asemenea, provine în mod natural din atmosferă ca urmare a reacției oxidului de azot cu apa. Acolo, în special în troposferă, acidul azotat intervine în reglarea concentrației de ozon.

O soluție HNO este prezentată în imaginea de mai susDouă unde se apreciază culoarea albastră pal caracteristică a acestui acid. Este sintetizat prin dizolvarea trioxidului de azot, NDouăSAU3, in apa. De asemenea, este produsul acidificării soluțiilor de nitrit de sodiu la temperaturi scăzute..
HNODouă Are o utilizare comercială redusă, fiind utilizat sub formă de nitriți în conservarea cărnii. Pe de altă parte, este utilizat la producerea coloranților azoici.
Este utilizat, împreună cu tiosulfatul de sodiu, în tratamentul pacienților cu otrăvire cu cianură de sodiu. Dar, este un agent mutagen și se crede că poate provoca substituții în bazele lanțurilor ADN, printr-o dezaminare oxidativă a citozinei și adeninei..
Acidul azotat are un comportament dublu, deoarece se poate comporta ca agent oxidativ sau ca agent reducător; adică poate fi redus la NO sau NDouă, te oxizi la HNO3.
Indice articol
- 1 Structura acidului azotat
- 2 Proprietăți
- 2.1 Denumiri chimice
- 2.2 Descrierea fizică
- 2.3 Greutate moleculară
- 2.4 Constanta de disociere
- 2.5 Punct de topire
- 2.6 Punctul de fierbere
- 2.7 Formarea sării
- 2.8 Potențial de foc
- 2.9 Descompunerea
- 2.10 Agent de reducere
- 2.11 Agent oxidant
- 3 Nomenclatură
- 4 Sinteza
- 5 Riscuri
- 6 utilizări
- 6.1 Producerea sărurilor de diazoniu
- 6.2 Eliminarea azidei de sodiu
- 6.3 Sinteza oximelor
- 6.4 În forma sa salină
- 7 Referințe
Structura acidului azotat
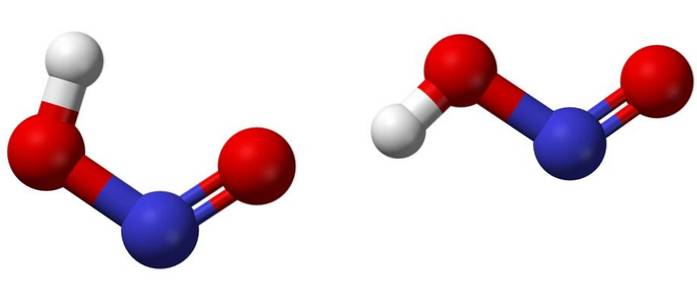
Imaginea superioară arată structura moleculară a acidului azotat utilizând un model de sfere și tije. Atomul de azot (sfera albastră) este situat în centrul structurii, formând o legătură dublă (N = O) și o legătură simplă (N-O) cu atomii de oxigen (sfere roșii).
Rețineți că atomul de hidrogen (sfera albă) este legat de unul dintre oxigeni și nu direct de azot. Deci, știind acest lucru, formula structurală a HNODouă este [HO-N = O] sau [NO (OH)] și nu există o astfel de legătură H-N (așa cum poate sugera formula chimică).
Moleculele din imagine corespund cu cele ale unei faze gazoase; în apă sunt înconjurați de molecule de apă, care pot accepta ionul hidrogen (slab) pentru a forma NO ioniDouă- si H3SAU+.
Structurile lor pot lua două forme: cis sau trans, numiți izomeri geometrici. În izomerul cis, atomul H este eclipsat de atomul de oxigen vecin; în timp ce în izomerul trans, ambele sunt în poziții anti sau opuse.
În izomerul cis este probabil formarea unei punți de hidrogen intramoleculare (OH-NO), care poate perturba cele intermoleculare (ONOH-ONOH)..
Proprietăți
Denumiri chimice
-Acid azotat
-Acid dioxonitric (III)
-Hidroxid de nitrosil
-Hidroxid oxidonitrogen (denumirea sistematică IUPAC)
Descriere Fizica
Lichid albastru pal, corespunzător soluției de nitriți.
Greutate moleculară
47,013 g / mol.
Constanta de disociere
Este un acid slab. PKa este de 3,35 la 25 ° C.
Punct de topire
Este cunoscut doar în soluție. Prin urmare, punctul său de topire nu poate fi calculat și nici cristalele sale nu pot fi izolate..
Punct de fierbere
Deoarece nu există pur, ci în apă, măsurătorile acestei proprietăți nu sunt precise. Pe de o parte, depinde de concentrația de HNODouă, iar pe de altă parte, încălzirea acestuia produce descompunerea sa. De aceea nu se raportează un punct de fierbere exact..
Formarea sării
Formează nitriți solubili în apă cu Li+, N / A+, K+, ACDouă+, DomnulDouă+, BaDouă+. Dar nu formează săruri cu cationi polivalenți, cum ar fi: Al3+ și / sau BeDouă+ (datorită densității sale mari de încărcare). Este capabil să formeze esteri stabili cu alcooli.
Potențial de foc
Este inflamabil prin reacții chimice. Poate exploda la contactul cu triclorură de fosfor.
Descompunere
Este un compus foarte instabil și, în soluție apoasă, se descompune în oxid azotic și acid azotic:
2 HNODouă => NUDouă + NU + HDouăSAU
4 HNODouă => 2 HNO3 + NDouăO + HDouăSAU
Agent de reducere
Acidul azotat în soluție apoasă apare sub formă de ioni de azot, NUDouă-, care suferă diverse reacții de reducere.
Reacționează cu ionii I- și credințăDouă+, sub formă de nitrit de potasiu, pentru a forma oxid nitric:
2 KNODouă + KI + HDouăSW4 => EuDouă + 2 NO + 2 HDouăO + KDouăSWDouă
Nitritul de potasiu în prezența ionilor de staniu este redus pentru a forma oxid de azot:
KNODouă + 6 HCI + 2 SnClDouă => 2 SnCl4 + NDouăO + 3 HDouăO + 2 KCl
Nitritul de potasiu este redus cu Zn într-un mediu alcalin, formând amoniac:
5 oreDouăO + KNODouă + 3 Zn => NH3 + KOH + 3 Zn (OH)Două
Agent oxidant
Pe lângă faptul că este un agent reducător, acidul azotat poate interveni în procesele de oxidare. De exemplu: oxidează hidrogenul sulfurat, transformându-se în oxid nitric sau amoniac, în funcție de aciditatea mediului în care are loc reacția.
2 HNODouă + HDouăS => S + 2 NO + 2 HDouăSAU
HNODouă + 3 HDouăS => S + NH3 + 2 oreDouăSAU
Acidul azotat, într-un mediu pH acid, poate oxida ionul de iodură la iod.
HNODouă + Eu- + 6 ore+ => 3 IDouă + NH3 + 2 oreDouăSAU
Poate acționa și ca agent reducător acționând asupra CuDouă+, dând naștere acidului azotic.
Nomenclatură
Pentru HNODouă Li se pot da alte nume, care depind de tipul de nomenclatură. Acidul azotat corespunde nomenclaturii tradiționale; acid dioxonitric (III), la nomenclatura stocului; și dioxonitrat de hidrogen (III), la sistematic.
Sinteză
Acidul azotat poate fi sintetizat prin dizolvarea trioxidului de azot în apă:
NDouăSAU3 + HDouăO => 2 HNODouă
O altă metodă de preparare constă în reacția nitritului de sodiu, NaNO3, cu acizi minerali; precum acidul clorhidric și acidul bromhidric. Reacția se efectuează la o temperatură scăzută și acidul azotat este consumat in situ..
Frate mai mare3 + H+ => HNODouă + N / A+
Ionul H+ provine fie din HCl, fie din HBr.
Riscuri
Având în vedere proprietățile și caracteristicile sale chimice, există puține informații despre efectele toxice directe ale HNO.Două. Poate că unele efecte nocive despre care se crede că sunt produse de acest compus sunt de fapt cauzate de acidul azotic, care poate fi produs prin descompunerea acidului azotat..
Se observă că HNODouă poate avea efecte nocive asupra căilor respiratorii și poate fi capabil să producă simptome iritante la pacienții astmatici.
Sub formă de nitrit de sodiu, acesta este redus de deoxihemoglobina, producând oxid nitric. Acesta este un vasodilatator puternic care produce relaxarea mușchilor netezi vasculari, estimând o doză LD50 de 35 mg / kg pentru consum oral la om..
Toxicitatea nitritului de sodiu se manifestă prin colaps cardiovascular, urmată de hipotensiune severă, datorită acțiunii vasodilatatoare a oxidului de azot, produs din nitrit..
Dioxid de azot, NUDouă, prezent în aerul poluat (smog), în anumite condiții poate provoca acid azotat; care, la rândul său, pot reacționa cu aminele pentru a forma nitrozamine, o gamă de compuși cancerigeni.
O reacție similară are loc cu fumul de țigară. S-au găsit reziduuri de nitrozamină care aderă la căptușeala interioară a vehiculelor fumătorilor.
Aplicații
Producerea sărurilor de diazoniu
Acidul azotat este utilizat în industrie la producerea sărurilor de diazoniu, prin reacția sa cu amine aromatice și fenoli.
HNODouă + ArNHDouă + H+ => ArN = NAr + HDouăSAU
Sărurile de diazoniu sunt utilizate în reacțiile de sinteză organică; de exemplu, în reacția Sandmeyer. În această reacție, substituirea unei grupări amino (HDouăN-), într-o amină aromatică primară, de către grupurile Cl-, Fr- și CN-. Pentru a obține aceste produse aromate, sunt necesare săruri cuproase.
Sărurile de diazoniu pot forma compuși azoici strălucitori care sunt folosiți ca coloranți și servesc, de asemenea, ca test calitativ pentru prezența aminelor aromatice..
Eliminarea azidei de sodiu
Acidul azotat este utilizat pentru îndepărtarea azidei de sodiu (NaN3), care este potențial periculos datorită tendinței sale de a exploda.
2 NaN3 + 2 HNODouă => 3 NDouă + 2 NO + 2 NaOH
Sinteza oximelor
Acidul azotat poate reacționa cu grupările cetonice pentru a forma oxime. Acestea pot fi oxidate pentru a forma acizi carboxilici sau reduse pentru a forma amine..
Acest proces este utilizat în prepararea comercială a acidului adipic, monomerul utilizat în producția de nailon. Este, de asemenea, implicat în producția de poliuretan și esterii săi sunt plastifianți, în principal din PVC.
În forma sa salină
Acidul azotat, sub formă de azotit de sodiu, este utilizat în tratarea și conservarea cărnii; deoarece previne creșterea bacteriană și este capabil să reacționeze cu mioglobina, producând o culoare roșu închis care face carnea mai atractivă pentru consum.
Aceeași sare este utilizată, împreună cu tiosulfatul de sodiu, în tratamentul intravenos al otrăvirii cu cianură de sodiu..
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- PubChem. (2019). Acid azotat. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Softschools. (2019). Acid azotat. Recuperat de la: Softschools.com
- Wikipedia. (2019). Acid azotat. Recuperat de pe: en.wikipedia.org
- Societatea Regală de Chimie. (2015). Acid azotat. Recuperat de pe: chemspider.com
- New World Encyclopedia. (2015). Acid azotat. Recuperat de pe: newworldencyclopedia.org
- DrugBank. (2019). Acid azotat. Recuperat de pe: drugbank.ca
- Formulare chimică. (2018). HNODouă. Recuperat de pe: formulacionquimica.com

Nimeni nu a comentat acest articol încă.