
Structura, proprietățile și utilizările fluorurii de potasiu (KF)
fluorură de potasiu Este o halogenură anorganică care constă dintr-o sare formată între metal și halogen. Formula sa chimică este KF, ceea ce înseamnă că pentru fiecare cation K+ există un F- echivalent. După cum se poate observa, interacțiunile sunt electrostatice și, ca urmare, nu există legături K-F covalente..
Această sare se caracterizează prin solubilitatea sa extremă în apă, motiv pentru care formează hidrați, absoarbe umezeala și este deliquescent. Prin urmare, este foarte ușor să pregătiți soluții apoase ale acestuia, care servesc ca sursă de anioni fluor pentru toate acele sinteze în care doriți să îl încorporați într-o anumită structură..
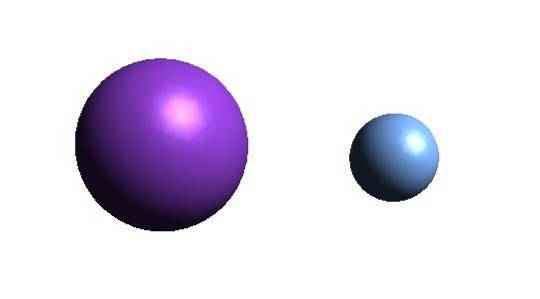
Deasupra este cationul K+ (sfera mov) și anionul F- (sfera albăstruie). Ambii ioni interacționează atrăgându-se reciproc prin sarcinile lor +1 și -1.
Deși KF nu este la fel de periculos ca HF, faptul că are anionul F-, o face o sare toxică. De aceea soluțiile lor au fost folosite ca insecticide.
KI este produs prin reacția carbonatului de potasiu cu acidul fluorhidric, producând bifluorură de potasiu (KHFDouă); care prin descompunere termică ajunge să producă fluorură de potasiu.
Indice articol
- 1 Structura fluorurii de potasiu
- 1.1 Hidrați
- 2 Proprietăți
- 2.1 Greutatea moleculară
- 2.2 Aspect fizic (culoare)
- 2.3 Aromă
- 2.4 Punctul de fierbere
- 2.5 Punct de topire
- 2.6 Solubilitate
- 2.7 Solubilitatea în apă
- 2.8 Densitate
- 2.9 Presiunea vaporilor
- 2.10 Descompunerea
- 2.11 Acțiune corozivă
- 2.12 Punct de aprindere
- 2.13 Indicele de refracție experimental (ηD)
- 2.14 Stabilitate
- 3 utilizări
- 3.1 Reglați pH-ul
- 3.2 Sursa de fluor
- 3.3 Sinteza fluorocarburilor
- 3.4 Fluorarea
- 3.5 Diverse
- 4 Referințe
Structura fluorurii de potasiu
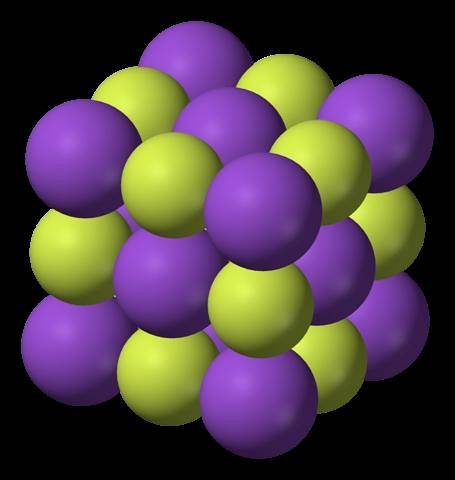
Imaginea superioară arată structura fluorurii de potasiu. Sferele mov, ca în prima imagine, reprezintă K cationi+; în timp ce sferele gălbui reprezintă anionii F-.
Rețineți că aranjamentul este cubic și corespunde unei structuri asemănătoare sării de rocă, foarte asemănătoare cu cea a clorurii de sodiu. Toate sferele sunt înconjurate de șase vecini, care alcătuiesc un octaedru KF6 sau FK6; adică fiecare K+ se înconjoară cu șase F-, și la fel se întâmplă și invers.
S-a menționat mai devreme că KF este higroscopic și, prin urmare, absoarbe umezeala din mediu. Acesta fiind cazul, aranjamentul arătat ar corespunde formei anhidre (fără apă) și nu hidraților săi; care absorb atât de multă apă încât chiar se solubilizează și se „topesc” (deliquescență).
Hidratați
Structurile cristaline ale hidraților devin mai puțin simple. De ce? Pentru că acum moleculele de apă intervin direct în aranjamente și interacționează cu ionii K+ și F-. Unul dintre cei mai stabili hidrați este KF2HDouăO și KF 4HDouăSAU.
În ambii hidrați octaedrele menționate anterior sunt deformate de moleculele de apă. Acest lucru se datorează în principal legăturilor de hidrogen dintre F- iar HDouăDE--HOH). Studiile cristalografice au stabilit că, în ciuda acestui fapt, cei doi ioni continuă să aibă același număr de vecini.
Ca urmare a tuturor acestor lucruri, structura cubică originală pentru fluorura de potasiu anhidră devine un aranjament monoclinic și chiar romboedru..
Cele anhidre împărtășesc proprietatea deliquescentă, astfel încât cristalele lor albe, dacă sunt lăsate în contact cu o ceață rece, ar deveni apoase în scurt timp..
Proprietăți
Greutate moleculară
58,097 g / mol.
Aspect fizic (culoare)
Cristale cubice albe sau pulbere cristalină albă deliquescentă.
Gust
Gust sărat ascuțit.
Punct de fierbere
2.741 ° F până la 760 mmHg (1502 ° C). În stare lichidă devine un conductor de electricitate, deși anionii F- nu colaborați în aceeași măsură ca K+.
Punct de topire
1.576 ° F; 858 ° C; 1131 K (KF anhidru). Acest lucru este indicativ al legăturilor sale ionice puternice..
Solubilitate
Solubil în HF, dar insolubil în alcool. Acest lucru arată că legăturile de hidrogen dintre fluor și alcooli, F--HOR, nu favorizați procesul de solvatare împotriva dizolvării rețelei sale de cristal.
Solubilitatea apei
Anhidru 92 g / 100 ml (18 ° C); 102 g / 100 ml (25 ° C); dihidrat 349,3 g / 100 ml (18 ° C). Adică, pe măsură ce KF este hidratat, devine mai solubil în apă..
Densitate
2,48 g / cm3.
Presiunea de vapori
100 kPa (750 mmHg) la 1.499 ºC.
Descompunere
Când este încălzit până la descompunere, emite un fum toxic de oxid de potasiu și fluor de hidrogen..
Acțiune corozivă
O soluție apoasă corodează sticla și porțelanul.
Punct de aprindere
Nu este o substanță inflamabilă
Indicele de refracție experimental (ηD)
1.363.
Stabilitate
Stabil dacă este protejat de umezeală, altfel solidul se va dizolva. Incompatibil cu acizi și baze puternice.
Aplicații
Reglați pH-ul
Soluțiile apoase de fluorură de potasiu sunt utilizate în aplicații și procese industriale; De exemplu, soluțiile KF permit ajustarea pH-ului în fabricarea în instalațiile de prelucrare a textilelor și în spălătorii (acestea îl aproximează la o valoare de 7).
Sursa de fluor
Fluorul de potasiu este după fluorură de hidrogen, principala sursă de obținere a fluorului. Acest element este utilizat în centralele nucleare și în producția de compuși anorganici și organici, unii cu utilizări precum încorporarea acestuia în pastele de dinți..
Sinteza fluorocarburilor
Fluorura de potasiu poate fi utilizată în sinteza fluorocarbonului sau fluorocarbonului din clorocarbon, utilizând reacția Finkeistein. Etilen glicol și dimetil sulfoxid sunt folosiți ca solvenți în această reacție..
Fluorinarea
Deoarece este o sursă de fluor în care se află dizolvată în apă, fluorurile complexe pot fi sintetizate din soluțiile sale; adică li se adaugă un F- la structuri. Un exemplu este în următoarea ecuație chimică:
MnBrDouă(ac) + 3KF (ac) => KMnF3(s) + 2KBr (ac)
KMnF fluorurat amestecat apoi precipită3. Astfel, F- astfel încât să facă parte dintr-o sare metalică complexă. Pe lângă mangan, pot fi precipitate fluoruri ale altor metale: KCoF3, KFeF3, KNiF3, KCuF3 și KZnF3.
La fel, fluorul poate fi încorporat covalent într-un inel aromatic, sintetizând organofluoruri.
Variat
KF este utilizat ca materie primă sau intermediară pentru sinteza compușilor care sunt utilizați în principal în produse agrochimice sau pesticide..
În plus, este utilizat ca agent de flux pentru suduri și pentru gravarea sticlei; adică soluția sa apoasă mănâncă la suprafața paharului și, pe o matriță, imprimă finisajul dorit.
Referințe
- Carte chimică. (2017). Fluorură de potasiu. Recuperat de pe: chemicalbook.com
- PubChem. (2019). Fluorură de potasiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- T. H. Anderson și E. C. Lincafelte. (1951). Structura dihidratului de fluorură de potasiu. Acta Cryst. 4, 181.
- Societatea Regală de Chimie. (2015). Fluorură de potasiu. ChemSpider. Recuperat de pe: chemspider.com
- Maquimex. (s.f.). Fluorură de potasiu. Recuperat de pe: maquimex.com



Nimeni nu a comentat acest articol încă.