
Structura acidului picric, sinteză, proprietăți și utilizări
acid picric este un compus chimic organic puternic nitrat al cărui nume IUPAC este 2,4,6-trinitrofenol. Formula sa moleculară este C6HDouă(NUDouă)3OH. Este un fenol foarte acid și poate fi găsit sub formă de picrat de sodiu, amoniu sau potasiu; adică în forma sa ionică C6HDouă(NUDouă)3Pe o.
Este un solid cu un puternic gust amar și de acolo își trage numele, din cuvântul grecesc „prikos”, care înseamnă amar. Se găsește sub formă de cristale galbene umede. Deshidratarea sau deshidratarea acestuia este periculoasă, deoarece crește proprietățile instabile care îl fac exploziv.
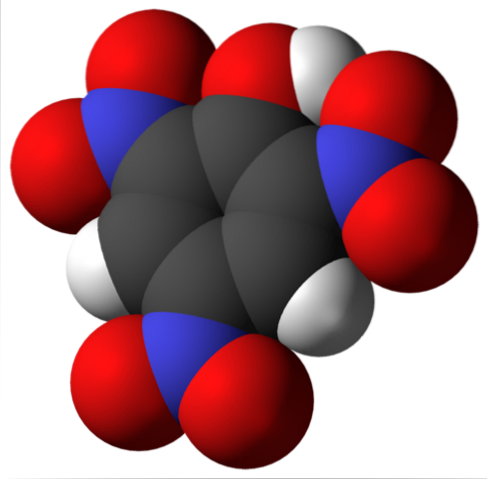
Molecula de acid picric este prezentată mai sus. În imagine este dificil să recunoaștem legăturile și atomii, deoarece aceasta corespunde reprezentării suprafeței sale a lui Van der Waals. Următoarea secțiune abordează structura moleculară mai detaliat..
Unii compuși intermediari, diverse săruri picrate și complexe de acid picric sunt sintetizate din acid picric..
Acidul picric este utilizat ca bază pentru sinteza coloranților galbeni permanenți. Unii patologi și cercetători îl folosesc în fixarea sau colorarea secțiunilor de țesut și în alte procese imunohistochimice..
Este foarte util în fabricarea produselor farmaceutice. În plus, este utilizat la producerea de chibrituri și explozivi. De asemenea, este utilizat pentru gravarea metalelor, pentru fabricarea sticlei colorate și pentru determinarea colorimetrică a parametrilor biologici, cum ar fi creatinina..
Pe de altă parte, acidul picric este iritant atunci când intră în contact cu pielea, mucoasa respiratorie, oculară și digestivă. Pe lângă deteriorarea pielii, poate afecta grav rinichii, sângele și ficatul, printre alte organe..
Indice articol
- 1 Structură
- 1.1 Fenol acid
- 1.2 Structura cristalină
- 2 Sinteza
- 2.1 Nitrarea directă a fenolului
- 3 Proprietăți fizice și chimice
- 3.1 Greutate moleculară
- 3.2 Aspect fizic
- 3.3 Miros
- 3.4 Aromă
- 3.5 Punct de topire
- 3.6 Punctul de fierbere
- 3.7 Densitate
- 3.8 Solubilitate
- 3.9 Corozivitate
- 3,10 pKa
- 3.11 Instabilitate
- 4 utilizări
- 4.1 Cercetare
- 4.2 Chimie organică
- 4.3 În industrie
- 4.4 Aplicații militare
- 5 Toxicitate
- 6 Referințe
Structura

Imaginea superioară arată toate legăturile și structura în sine a moleculei de acid picric în detaliu. Se compune dintr-un fenol cu trei substituenți nitro.
Se poate observa că în grupurile NUDouă atomul de azot are o sarcină parțială pozitivă și, prin urmare, solicită densitatea electronilor din împrejurimile sale. Dar, inelul aromatic atrage, de asemenea, electroni spre el însuși și înainte de cele trei NODouă ajunge să renunțe la o parte din propria densitate electronică.
Ca o consecință a acestui fapt, oxigenul grupului OH tinde mai mult să împartă una dintre perechile sale electronice gratuite pentru a furniza deficiența electronică suferită de inel; și făcând acest lucru, se formează legătura C = O+-H. Această sarcină parțială pozitivă asupra oxigenului slăbește legătura O-H și crește aciditatea; adică va fi eliberat sub formă de ion hidrogen, H+.
Acid fenol
Din acest motiv, acest compus este un acid extrem de puternic (și reactiv), chiar mai mult decât acidul acetic însuși. Cu toate acestea, compusul este de fapt un fenol a cărui aciditate îl depășește pe cel al celorlalți fenoli; datorită, așa cum am menționat, substituenților NODouă.
Prin urmare, deoarece este un fenol, grupul OH are prioritate și direcționează enumerarea în structură. Cele trei NUDouă acestea sunt situate la carbonii 2, 4 și 6 ai inelului aromatic în raport cu OH. De aici derivă nomenclatura IUPAC pentru acest compus: 2,4,6-Trinitrophenol (TNP).
Dacă grupurile nu erau acolo, NUDouă, sau dacă ar exista un număr mai mic în inel, legătura O-H ar slăbi mai puțin și, prin urmare, compusul ar avea o aciditate mai mică.
Structură cristalină
Moleculele de acid picric sunt aranjate în așa fel încât să le favorizeze interacțiunile intermoleculare; fie pentru formarea de legături de hidrogen între grupările OH și NODouă, forțe dipol-dipol sau repulsii electrostatice între regiunile deficitare de electroni.
S-ar putea aștepta ca grupurile să NUDouă se respingeau reciproc și se orientau în direcția inelelor aromatice vecine. De asemenea, inelele nu ar putea să se alinieze unul peste celălalt din cauza repulsiilor electrostatice crescute..
Produsul tuturor acestor interacțiuni, acidul picric reușește să formeze o rețea tridimensională care definește un cristal; a cărei celulă unitară corespunde unui sistem cristalin de tip ortorombic.
Sinteză
Inițial, a fost sintetizat din compuși naturali, cum ar fi derivați de corn animal, rășini naturale, printre altele. Începând din 1841, fenolul a fost folosit ca precursor al acidului picric, urmând diferite căi sau prin diferite proceduri chimice.
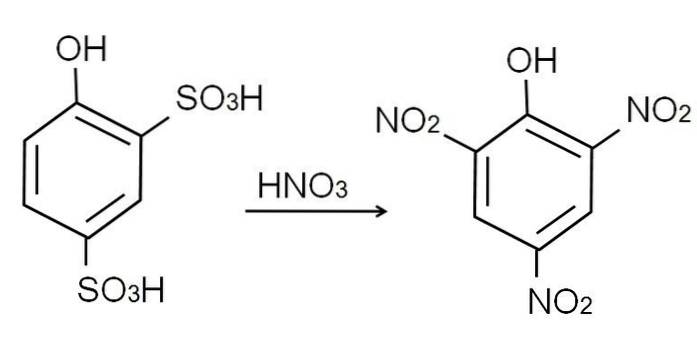
După cum sa menționat deja, este unul dintre cei mai acizi fenoli. Pentru a-l sintetiza, fenolul este supus mai întâi unui proces de sulfonare, urmat de un proces de nitrare..
Sulfonarea fenolului anhidru se efectuează prin tratarea fenolului cu acid sulfuric fumigant, producând substituții aromatice electrofile ale H prin grupări sulfonat, SO3H, în poziția -orto și -pară față de grupul OH.
Acest produs, acidul 2,4-fenoldisulfonic, este supus procesului de nitrare, tratându-l cu acid azotic concentrat. Procedând astfel, cele două grupuri SO3H se înlocuiesc cu grupări nitro, NODouă, iar un al treilea intră în cealaltă poziție nitro. Următoarea ecuație chimică ilustrează acest lucru:
Nitrarea directă a fenolului
Procesul de nitrare a fenolului nu poate fi realizat direct, deoarece sunt generate gudroane cu greutate moleculară mare. Această metodă de sinteză necesită un control foarte atent al temperaturii, deoarece este foarte exotermă:
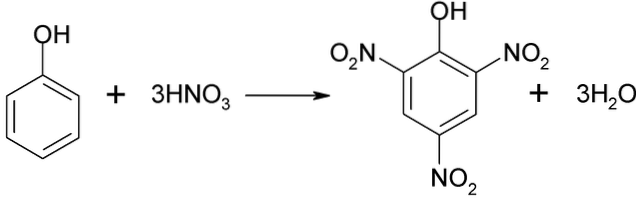
Acidul picric poate fi obținut prin efectuarea procesului de nitrare directă a 2,4-dinitrofenolului, cu acid azotic.
O altă modalitate de sinteză este tratarea benzenului cu acid azotic și azotat mercuric..
Proprietati fizice si chimice
Greutate moleculară
229,104 g / mol.
Aspectul fizic
Masă galbenă sau suspensie de cristale umede.
Miros
Este inodor.
Gust
Este foarte amar.
Punct de topire
122,5 ° C.
Punct de fierbere
300 ° C. Dar, când este topit, acesta explodează.
Densitate
1,77 g / ml.
Solubilitate
Este un compus moderat solubil în apă. Acest lucru se datorează faptului că grupurile sale OH și NODouă pot interacționa cu moleculele de apă prin legături de hidrogen; deși inelul aromatic este hidrofob și, prin urmare, îi afectează solubilitatea.
Corozivitate
Acidul picric este în general coroziv pentru metale, cu excepția staniu și aluminiu.
pKa
0,38. Este un acid organic puternic.
Instabilitate
Acidul picric se caracterizează prin proprietăți instabile. Constituie un risc pentru mediu, este instabil, exploziv și toxic.
Ar trebui depozitat bine închis pentru a evita deshidratarea, deoarece acidul picric este foarte exploziv dacă este lăsat să se usuce. Trebuie acordată o mare atenție formei sale anhidre, deoarece este foarte sensibilă la frecare, șoc și căldură..
Acidul picric trebuie depozitat în locuri reci și ventilate, departe de materialele oxidabile. Este iritant la contactul cu pielea și membranele mucoase, nu trebuie ingerat și este toxic pentru organism.
Aplicații
Acidul picric a fost utilizat pe scară largă în cercetare, chimie, industrie și armată..
Investigație
Atunci când este utilizat ca fixativ pentru celule și țesuturi, îmbunătățește rezultatele colorării acestora cu coloranți acizi. Se întâmplă cu metodele de colorare tricrom. După fixarea țesutului cu formalină, se recomandă o nouă fixare cu acid picric..
În acest fel, se garantează o colorare intensă și foarte strălucitoare a țesăturilor. Nu obțineți rezultate bune cu coloranții de bază. Cu toate acestea, trebuie luate măsuri de precauție, deoarece acidul picric poate hidroliza ADN-ul dacă este lăsat prea mult timp..
Chimie organica
-În chimia organică este utilizat ca picrați alcalini pentru a efectua identificarea și analiza diferitelor substanțe.
-Este utilizat în chimia analitică a metalelor.
-În laboratoarele clinice este utilizat la determinarea nivelurilor serice și creatininei urinare..
-De asemenea, a fost utilizat în unii dintre reactivii utilizați pentru analiza nivelurilor de glucoză..
În industrie
-La nivelul industriei fotografice, acidul picric a fost utilizat ca sensibilizant în emulsiile fotografice. A făcut parte din producția de produse precum pesticide, insecticide puternice, printre altele.
-Acidul picric este utilizat pentru a sintetiza alți intermediari chimici, cum ar fi cloropicrina și acidul picramic, de exemplu. Din acești compuși au fost fabricate unele medicamente și coloranți pentru industria pielăriei..
-Acidul picric a ajuns să fie utilizat în tratamentul arsurilor, ca antiseptic și alte afecțiuni, înainte ca toxicitatea acestuia să devină evidentă.
-Componentă importantă datorită naturii sale explozive la fabricarea chibriturilor și a bateriilor.
Aplicații militare
-Datorită explozivității ridicate a acidului picric, acesta a fost utilizat în instalațiile de muniție pentru armele militare.
-Acidul picric presat și topit a fost utilizat în obuze de artilerie, grenade, bombe și mine.
-Sarea de amoniu a acidului picric a fost utilizată ca exploziv, este foarte puternică, dar mai puțin stabilă decât TNT. Pentru o vreme a fost folosit ca o componentă a combustibilului pentru rachete.
Toxicitate
S-a dovedit că este foarte toxic pentru corpul uman și, în general, pentru toate ființele vii.
Se recomandă evitarea inhalării și ingestiei, datorită toxicității sale orale acute. De asemenea, provoacă mutații în microorganisme. Are efecte toxice asupra animalelor sălbatice, mamiferelor și mediului în general.
Referințe
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (10a ediție.). Wiley plus.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Wikipedia. (2018). Acid picric. Recuperat de pe: en.wikipedia.org
- Universitatea Purdue. (2004). Explozie de acid picric. Recuperat de la: chemed.chem.purdue.edu
- Proiectul Crystallography 365. (10 februarie 2014). Mai puțin decât galben moale - structura acidului picric. Recuperat de pe: crystallography365.wordpress.com
- PubChem. (2019). Acid picric. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Acid picric. Methuen, Londra, Marea Britanie.


Nimeni nu a comentat acest articol încă.