
Formula acidului percloric, caracteristici și utilizări

acid percloric Este un acid mineral foarte puternic, care se găsește de obicei ca o soluție apoasă incoloră și inodoră, corozivă pentru metale și țesături. Este un oxidant puternic când este fierbinte, dar soluțiile sale apoase (până la aproximativ 70% din greutate) la temperatura camerei sunt în general sigure, prezentând doar caracteristici puternice de acid și fără proprietăți oxidante..
Acid percloric și sărurile sale (în special perclorat de amoniu [NH4ClO4, CAS: 7790-98-9], perclorat de sodiu [NaClO4, 7601-89-0] și perclorat de potasiu [KClO4, 7778-74- 7]), găsesc multe aplicații datorită puterii lor puternice de oxidare.

Producția sa a crescut datorită utilizării sale ca materie primă pentru producția de perclorat de amoniu pur, un ingredient de bază în explozivi și propulsori solizi pentru rachete și rachete..

Acidul percloric este, de asemenea, utilizat, la scară limitată, ca reactiv în scopuri analitice. Recipientele sale închise pentru containere se pot rupe violent la expunere prelungită la căldură..
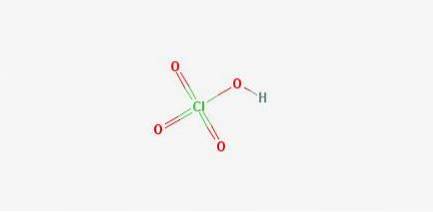
Formule: Acid percloric: HClO4
CAS: 7601-90-3
Structura 2D
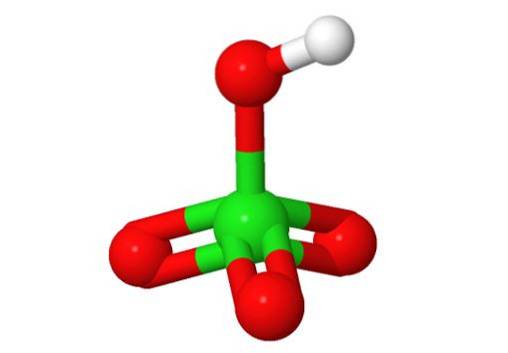
Structura 3D
Caracteristicile acidului percloric
Proprietati fizice si chimice
- Aspect: lichid incolor
- Miros: inodor
- Greutate moleculară: 100,454 g / mol
- Punct de fierbere: 19 ° C
- Punct de topire: -112 ° C
- Densitate: 1.768 g / cm3
- Solubilitate în apă: miscibil
- Aciditate (pKa): -15,2 (± 2,0)
Acidul percloric aparține grupului de acizi oxidanți puternici.
Inflamabilitate
-Acizii oxidanți puternici nu sunt în general inflamabili, dar pot accelera arderea altor materiale prin furnizarea de oxigen (acționând ca agenți de oxidare).
-Soluțiile de acid percloric pot exploda din cauza căldurii sau a contaminării.
-Când sunt încălzite la peste 160 ° C sau implicate într-un incendiu, acestea se pot descompune exploziv.
-Pot reacționa exploziv cu hidrocarburi (combustibili). Poate aprinde combustibili (lemn, hârtie, ulei, îmbrăcăminte etc.).
-Recipientele pot exploda la încălzire.
-Scurgerea poate crea pericol de incendiu sau explozie.
Reactivitate
-Acizii oxidanți puternici sunt în general solubili în apă cu eliberarea ionilor de hidrogen. Soluțiile rezultate au un pH de 1 sau aproape de 1.
-Materialele din acest grup reacționează cu baze chimice (de exemplu, amine anorganice și hidroxizi) pentru a forma săruri. Aceste reacții de neutralizare apar atunci când baza acceptă ioni de hidrogen pe care acidul îi donează.
-Neutralizările pot genera cantități periculoase de căldură în spații mici.
-Adăugarea de apă la acizi generează adesea suficientă căldură în regiunea mică a amestecului pentru a fierbe exploziv acea parte a apei, ceea ce poate duce la stropiri de acid foarte periculoase..
-Aceste materiale au o capacitate semnificativă ca agenți de oxidare, dar această capacitate variază de la unul la altul..
-Ele pot reacționa cu metale active (cum ar fi fierul și aluminiul) și, de asemenea, cu multe metale mai puțin active, pentru a dizolva metalul și a elibera hidrogen și / sau gaze toxice.
-Reacțiile sale cu sărurile de cianură și compușii săi eliberează hidrogen cianură gazoasă..
-Gazele inflamabile și / sau toxice sunt, de asemenea, generate de reacțiile lor cu ditiocarbamați, izocianați, mercaptani, nitriți, nitrili, sulfuri și agenți reductori slabi sau puternici..
-Reacții suplimentare de generare a gazelor apar cu sulfiți, nitriți, tiosulfati (pentru a da H2S și SO3), ditioniți (SO2) și chiar carbonați: dioxidul de carbon gaz al acestuia din urmă nu este toxic, dar căldura și stropirea din reacție pot fi supărate.
-Soluțiile de acid percloric sunt soluții puternice de acid oxidant.
-Ele pot reacționa viguros sau detona, atunci când sunt amestecate cu materiale oxidabile (alcooli, amine, borani, dicianogen, hidrazine, hidrocarburi, hidrogen, nitroalcani, metale praf, silani și tioli, printre altele).
-Acidul percloric se aprinde la contactul cu clorura de sulfinil.
Toxicitate
-Acizii oxidanți puternici sunt corozivi pentru țesături. Fumurile acide irită grav țesuturile sensibile (cum ar fi ochii și sistemul respirator).
-Inhalarea, ingestia sau contactul (cu pielea, ochii etc.) cu soluții de acid percloric sau vaporii acestuia pot provoca leziuni grave, arsuri sau moarte..
-Când intră în contact cu focul, pot produce gaze iritante, corozive și / sau toxice..
-Scurgerea de la controlul focului sau apa de diluare poate provoca contaminare.
Aplicații
-Acidul percloric este utilizat în domeniile cercetării și dezvoltării științifice, precum și în fabricarea de produse chimice și echipamente electrice, electronice și optice.
-Este utilizat ca precursor în producția de perclorat de amoniu pur, un ingredient de bază în explozivi și propulsori solizi pentru rachete și rachete..
-Utilizarea acidului percloric în casă include produse de toaletă, produse de curățat metalice și de scurgere, agenți de îndepărtare a ruginii, în baterii și ca grund pentru unghii false..
-Utilizările industriale includ: rafinarea metalelor, instalații sanitare, albire, gravare, galvanizare, fotografiere, dezinfectare, muniție, fabricarea îngrășămintelor, curățarea metalelor și îndepărtarea ruginii.
-Acidul percloric este, de asemenea, utilizat, la scară limitată, ca reactiv în scopuri analitice..
Efecte clinice
Acizii provoacă necroză de coagulare. Ionii de hidrogen desicează celulele epiteliale, provocând edem, eritem, vărsare de țesut și necroză, cu formarea de ulcere și escare..
La expunerea la acești acizi pe cale gastro-intestinală, pacienții pot dezvolta arsuri de gradul II (vezicule superficiale, eroziuni și ulcerații) care prezintă riscul formării ulterioare a stricturii, în special calea gastrică și esofagul..
Se pot dezvolta și arsuri profunde și necroză a mucoasei gastro-intestinale. Complicațiile includ adesea perforația (esofagiană, gastrică, rareori duodenală), formarea fistulei (traheoesofagiană, aortoesofagiană) și sângerarea gastrointestinală..
Expunerea prin inhalare poate provoca dispnee, dureri toracice pleuritice, tuse și bronhospasm, edem respirator superior și arsuri. Edemul respirator superior este frecvent și adesea pune viața în pericol.
Expunerea la ochi poate provoca iritații conjunctivale severe și chimioză, defecte epiteliale ale corneei, ischemie limbică, pierderea permanentă a vederii și în cazuri severe de perforație..
Expunerea cutanată ușoară poate provoca iritații și arsuri de grosime parțială. Expunerea la concentrații mai mari sau mai mari poate provoca arsuri cu grosime totală.
Complicațiile pot include celulită, sepsis, contracturi, osteomielită și toxicitate sistemică.
Siguranță și riscuri
Declarații de pericol ale Sistemului global armonizat de clasificare și etichetare a substanțelor chimice (GHS)
Sistemul global de armonizare a clasificării și etichetării substanțelor chimice (GHS) este un sistem agreat la nivel internațional, creat de Națiunile Unite și conceput pentru a înlocui diferitele standarde de clasificare și etichetare utilizate în diferite țări prin utilizarea unor criterii consistente la nivel global..
Clasele de pericol (și capitolul GHS corespunzător), standardele de clasificare și etichetare și recomandările pentru acidul percloric sunt următoarele (Agenția Europeană pentru Produse Chimice, 2017; Națiunile Unite, 2015; PubChem, 2017):
Declarații de pericol GHS
H271: Poate provoca incendiu sau explozie; Oxidant puternic [Pericol Lichide oxidante; Solidele oxidante - Categoria 1] (PubChem, 2017).
H290: Poate fi coroziv pentru metale [Avertisment coroziv pentru metale - Categoria 1] (PubChem, 2017).
H302: Nociv prin înghițire [Avertisment Toxicitate acută, orală - Categoria 4] (PubChem, 2017).
H314: Provoacă arsuri grave ale pielii și leziuni oculare [Pericol Coroziune / iritare a pielii - Categoria 1A, B, C] (PubChem, 2017).
H318: Provoacă leziuni oculare grave [Pericol Leziuni oculare grave / iritarea ochilor - Categoria 1] (PubChem, 2017).
H371: Poate provoca leziuni ale organelor [Avertisment Toxicitate specifică asupra organelor țintă, expunere unică - Categoria 2] (PubChem, 2017).
Coduri de instrucțiuni de precauție
P210, P220, P221, P234, P260, P264, P270, P280, P283, P301 + P312, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P306 + P360, P30 P311, P310, P321, P330, P363, P370 + P378, P371 + P380 + P375, P390, P404, P405 și P501 (PubChem, 2017).





Referințe
- Agenția Europeană pentru Produse Chimice (ECHA). (2016). Acid percloric. Scurt profil. Adus pe 8 februarie 2017, de pe: echa.europa.eu.
- JSmol (2017) Acid percloric. [imagine] Recuperat de pe: chemapps.stolaf.edu.
- NASA (2008) Ares-1 lansează 02-2008 [imagine] Recuperat de pe: commons.wikimedia.org.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date compusă PubChem. (2017). Acid percloric - Structura PubChem. [imagine] Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Oelen, W. (2011) Acid percloric 60% [imagine] Recuperat de la: en.wikipedia.org.
- Wikipedia. (2017). Acid percloric. Adus la 8 februarie 2017, de pe: es.wikipedia.org.
- Wikipedia. (2017). Acid percloric. Adus la 8 februarie 2017, de pe: es.wikipedia.org.


Nimeni nu a comentat acest articol încă.