
Structura acidului sulfamic, proprietăți, sinteză, utilizări

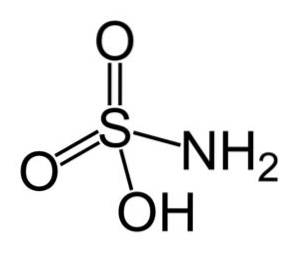
acid sulfamic este un compus anorganic format dintr-un atom de sulf (S) legat covalent și printr-o legătură simplă la o grupare hidroxil (-OH) și la o grupare amino (-NHDouă), și prin dublă legătură la doi atomi de oxigen (O). Este un solid cristalin alb. Formula sa chimică este NHDouăSW3H. De asemenea, cunoscut sub numele de acid aminosulfonic, acid amidosulfonic, acid amidosulfuric și acid sulfamidic..
Acidul sulfamic este un acid puternic. Poate reacționa cu metale, oxizi metalici și carbonați. Sărurile sale sunt, în general, solubile în apă, făcându-l un bun agent de îndepărtare a scării în echipamentele de proces. Este frecvent utilizat în fabricile de zahăr pentru a curăța incrustațiile de carbonat din echipamentele de evaporare..
Acidul sulfamic este un reductor de azotit (NODouă-) și această proprietate chimică este utilizată în diverse aplicații, cum ar fi în industria coloranților și în analiza nitriților..
Se folosește la tăbăcirea pielii și la albirea celulozei pentru fabricarea hârtiei. De fapt, este un contaminant alimentar, deoarece se găsește adesea în hârtiile și cartonul utilizate pentru ambalarea alimentelor..
Este, de asemenea, utilizat în electrodepunerea metalelor, ca standard de laborator și unul dintre derivații săi este un erbicid foarte eficient..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 3,6 pH
- 3.7 Constanta de disociere
- 3.8 Proprietăți chimice
- 3.9 Alte proprietăți
- 4 Sinteza
- 5 utilizări
- 5.1 În industria vopselelor
- 5.2 În prelucrarea pielii
- 5.3 În echipamentul de curățare
- 5.4 În rafinarea metalelor
- 5.5 Ca reactiv standard în laborator
- 5.6 În analiza nitriților
- 5.7 În analiza oxigenului dizolvat în apă
- 5.8 La prepararea oxidului de azot
- 5.9 În agricultură
- 5.10 Pe țesături ignifuge
- 5.11 În diverse aplicații
- 6 Referințe
Structura
Acidul sulfamic cristalizează sub formă de cristale ortirombice dipiramidale. Formează prisme și foi compacte atunci când cristalizează din soluție rece, precum și foi de diamant când cristalizează din soluție apoasă fierbinte.
Nomenclatură
- Acid sulfamic
- Acid aminosulfonic
- Acid amidosulfonic
- Acid amidosulfuric
- Acid sulphamidic
Proprietăți
Starea fizică
Solid cristalin alb.
Greutate moleculară
97,1 g / mol.
Punct de topire
205 ºC, se descompune la 209 ºC.
Densitate
2,15 g / cm3
Solubilitate
Solubil în apă:
- 12,8% la 0 ° C
- 17,57% la 20 ° C
- 22,77% la 40 ° C
Ușor solubil în metanol, ușor solubil în acetonă, insolubil în eter.
Liber solubil în baze azotate și în solvenți organici care conțin azot.
Insolubil în disulfură de carbon (CSDouă) și tetraclorură de carbon (CCl4).
pH
0,41 (în soluție 1 N, adică 1 echivalent / L).
Constanta de disociere
0,101 la 25 ° C.
Proprietăți chimice
Este un acid puternic. Aproape la fel de mult ca clorhidric (HCI), azotic (HNO3) și sulfuric (HDouăSW4).
Soluțiile apoase de acid sulfamic sunt puternic ionizate. PH-ul său este mai mic decât soluțiile de acizi formici, fosforici și oxalici.
În apă, acidul sulfamic pierde doar protonul legat de oxigen. Hidrogenii legați de azot se mențin strâns împreună.
În soluție apoasă se hidrolizează lent pentru a da sulfat de amoniu acid (NH4HSO4). Este stabil în condiții uscate.
Acidul sulfamic atacă metalele, oxizii metalici și carbonații pentru a genera sulfamați. De exemplu, cu metalul potasiu (K) formează sulfat de potasiu (KOSODouăNHDouă) și hidrogen (HDouă).
Toate sărurile acidului sulfamic sunt solubile în apă. Sărurile de calciu, plumb și bariu sunt foarte solubile în apă, spre deosebire de sărurile corespunzătoare ale acidului sulfuric.
Acid azotat (HNODouă) reacționează cantitativ cu gruparea amino a acidului sulfamic, eliberând azot (NDouă). Se estimează că ionul sulfat funcționează în această reacție ca o amidă, nu ca o amină..
Acidul sulfamic este oxidat de clor, brom sau clorat de potasiu pentru a-l transforma în acid sulfuric. Această reacție nu are loc cu alți oxidanți, cum ar fi acidul crom sau permanganatul de potasiu..
Nu este compatibil (reacționează) cu alcalii puternici, clor, acid hipocloros, hipocloriti, cianuri și sulfuri.
Alte proprietăți
Nu este higroscopic (asta înseamnă că nu absoarbe umezeala din aer).
Când este încălzit până la descompunere, emite vapori foarte toxici de oxizi de sulf și clorură de hidrogen (HCl).
Unul dintre derivații săi, sulfamatul de amoniu, este un ignifug.
Este moderat toxic.
Sinteză
Acidul sulfamic se obține prin reacția ureei CO (NHDouă)Două cu acid sulfuric fumigant, adică acid sulfuric (HDouăSW4) concentrat care conține trioxid de sulf (SO3).
Poate fi sintetizat și prin reacția acidului clorosulfonic (HClO3Cl) și amoniac (NH3).
Aplicații
În industria vopselelor
Acidul sulfamic este utilizat pentru a elimina excesul de nitriți rapid și eficient în reacțiile de diazotizare în sinteza coloranților. Este mult mai practic decât ureea în acest scop.
În prelucrarea pielii
În timpul tăbăcirii pielii, utilizarea acidului sulfamic în locul acidului sulfuric oferă o textură mai fină și mătăsoasă.
În plus, deoarece sulfamatul de calciu este solubil în apă, spre deosebire de sulfatul de calciu, acidul sulfamic poate fi utilizat în procesul de delimitare fără a lăsa petele care apar uneori pe piele atunci când se utilizează acid sulfuric..

În procesul de curățare a echipamentelor
Acidul sulfamic este utilizat ca detergent de detartraj în ceainici, reactoare, țevi, sisteme de răcire și schimbătoare de căldură.
În acest echipament, incrustațiile se formează prin circulația apei sau a compușilor de proces în centralele electrice, uzinele chimice, fabricile de oțel, fabricile de hârtie, stațiile de compresie și alte industrii..
Depunerile solzi sau solide pot fi organice (alge, nămol, ciuperci) sau anorganice (oxizi de fier, sulfuri de fier, carbonați de calciu sau magneziu, sulfați, fosfați sau silicați).
Acidul sulfamic este foarte eficient atunci când este utilizat pentru îndepărtarea solului de carbonat de calciu. Poate fi folosit pe echipamente de cupru, alamă, oțel inoxidabil, fontă și oțel zincat.
Se utilizează sub formă de soluție de 5-10% din greutate. Este folosit în special în fabricile de zahăr pentru curățarea evaporatoarelor din fontă cu schimbătoare de căldură din cupru.

Ar trebui să fie utilizat la temperaturi de cel mult 50-60 ºC. Temperaturile de 70 ° C conduc la formarea de sulfați insolubili precum CaSO4.
Atunci când este utilizată în combinație cu clorură de sodiu, are loc un efect sinergic, iar soluția permite oxidului feric să se dizolve încet. În acest caz, nu trebuie utilizat cu oțel inoxidabil deoarece este eliberat acid clorhidric, ceea ce poate provoca coroziune în acest material..
În rafinarea metalelor
Galvanizarea metalelor precum cupru, argint, cobalt, nichel, zinc, cadmiu, fier și plumb poate fi realizată cu succes în soluții de acid sulfamic. Acest lucru poate fi manipulat mult mai ușor decât acidul fluorhidrosilicic (HDouăSiF6).
Ca reactiv standard în laborator
Având în vedere anumite caracteristici ale acidului sulfamic, cum ar fi: puterea sa ca acid, ușurința sa de a fi purificat prin recristalizare în apă, stabilitatea și non-higroscopicitatea sa, a fost utilizat ca standard primar la nivel de laborator. Aceasta înseamnă că este utilizat pentru determinări cantitative de alcali..

În analiza nitriților
Datorită reacției sale ușoare cu nitriți, acidul sulfamic este utilizat pentru determinarea acestora în soluție..
În analiza oxigenului dizolvat în apă
Deoarece acidul sulfamic reacționează cu nitriții din apă, azotul este eliberat, este posibil să se efectueze determinarea oxigenului dizolvat în apă, deoarece interferența cauzată de nitriți este eliminată..
La prepararea oxidului de azot
Acidul sulfamic reacționează cu acidul azotic pentru a genera oxid de azot (NDouăSAU). Această reacție este mai sigură decât cea a azotatului de amoniu pentru a obține acest gaz.
În agricultură
Un derivat al acidului sulfamic, sulfamatul de amoniu, este un erbicid netoxic eficient pentru animale.
Se aplică prin rouă pe frunzele speciei pentru a fi îndepărtate la sfârșitul verii sau începutul toamnei, de preferință pe vreme umedă. Pe măsură ce compusul se deplasează de la frunze la rădăcini, planta moare.

Un alt avantaj al acestui compus este că nu sterilizează permanent solul. Într-adevăr, o parte din azotul din sulfamatul de amoniu va fi disponibil în sol pentru creșterea plantelor în sezonul următor..
În țesături ignifuge
Compatibilitatea sa cu celuloză și caracteristicile sale ignifuge fac din sulfatul de amoniu un agent pentru obținerea de țesături și hârtie rezistente la foc..
Se folosește la 10% din greutatea țesăturii, al cărei aspect și simț la atingere rămân nealterate. Țesătura în timpul utilizării trebuie curățată la uscat, niciodată spălată cu apă pentru a nu dizolva sulfamatul.
Este util mai ales în perdele de teatru sau în locuri similare.

În diverse aplicații
Este utilizat ca catalizator în unele reacții chimice, cum ar fi la prepararea rășinilor de uree-formaldehidă. Este, de asemenea, util ca bactericid și stabilizator de clor în piscine și ca înălbitor pentru pastă de lemn în fabricile de celuloză și hârtie..
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Acid sulfamic. Recuperat de la pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrozarea la centrele de azot. În reacțiile de nitrozație și chimia oxidului nitric. Capitolul 2. Recuperat de la sciencedirect.com
- Clapp, Leallyn B. (1943). Acid sulfamic și utilizările sale. Chem. Educ. 1943, 20, 4, 189. Recuperat de la pubs.acs.org
- McDonald, James. (2003). Acid sulfamic. Recuperat de pe veoliawatertech.com
- Sastri, V.S. (2010). Managementul și controlul coroziunii. În coroziunea lui Shreir. Recuperat de la sciencedirect.com
- Pratima Bajpai. (2018). Subiecte diverse. În Manualul lui Biermann de celuloză și hârtie. A treia editie. Recuperat de la sciencedirect.com



Nimeni nu a comentat acest articol încă.