
Structura, utilizările, proprietățile citratului de sodiu (C6H5O7Na3)
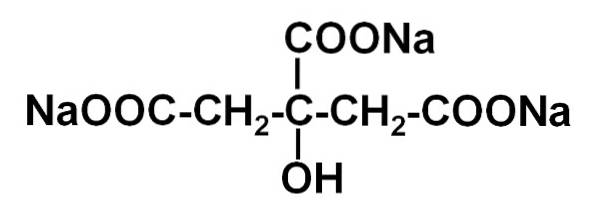
citrat de sodiu Este sarea de sodiu a acidului citric. Este format dintr-un anion citrat C6H5SAU73- și trei cationi de sodiu Na+. Formula sa moleculară este C6H5SAU7N / A3 sau în forma sa extinsă: NaOOC-CHDouă-C (COONa) (OH) -CHDouă-COONa. Citratul de sodiu este baza conjugată a acidului citric, adică se obține teoretic din acesta înlocuind fiecare proton H+ de -COOH pentru un Na sodic+.
Poate fi preparat sub formă anhidră (fără apă în compoziția sa) sau sub forma sa hidratată cu 2 sau 5 molecule de apă. Este un compus care atunci când anhidru (fără apă) tinde să absoarbă apa din mediu.
Citratul de sodiu acționează ca un tampon, ceea ce înseamnă că stabilizează pH-ul, care este o măsură a acidității sau bazicității unei soluții apoase. De asemenea, are proprietatea de a forma un compus stabil cu ioni de calciu.Două+, citrat de calciu.
Se folosește în industria alimentară, de exemplu, pentru a preveni formarea de bulgări de lapte de vacă greu digerabil pentru sugari.
În laboratoarele de teste biologice este utilizat pentru a preveni coagularea sângelui prelevat de la pacienți pentru anumite teste. De asemenea, previne coagularea sângelui utilizat în transfuzii. Este utilizat pe scară largă în detergenții fără fosfați, deoarece nu poluează.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Solubilitate
- 3,5 pH
- 3.6 Proprietăți chimice
- 3.7 Alte proprietăți
- 4 Obținerea
- 4.1 Amplasarea în natură
- 5 utilizări
- 5.1 În industria alimentară
- 5.2 În medicină
- 5.3 În industria farmaceutică
- 5.4 În analizele de sânge
- 5.5 În sinteza nanoparticulelor
- 5.6 La detergenții ecologici
- 5.7 În îmbunătățirea exploatării nisipurilor de gudron
- 5.8 În alte aplicații
- 6 Referințe
Structura
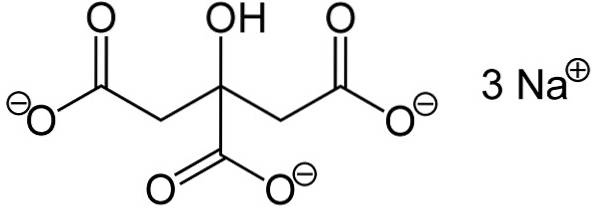
Citratul trisodic este alcătuit din trei ioni de sodiu Na+ și un ion citrat.
Ionul citrat este alcătuit dintr-un lanț de trei atomi de carbon de care sunt atașați 3 carboxilați -COO- (câte unul pentru fiecare atom de carbon) și un hidroxil -OH la carbonul central.
Fiecare dintre cei 3 ioni Na+ este atașat unui grup -COO-.
Nomenclatură
- Citrat de sodiu
- Citrat de trisodiu
- 2-hidroxipropan-1,2,3-tricarboxilat de trisodiu
Proprietăți
Starea fizică
Solid cristalin alb sau incolor.
Greutate moleculară
258,07 g / mol
Punct de topire
300 ºC
Solubilitate
Este foarte solubil în apă: 42,5 g / 100 ml la 25 ° C. Este practic insolubil în alcool.
pH
O soluție apoasă de 5% de citrat de sodiu are un pH cuprins între 7,5 și 9,0, adică este ușor alcalin.
Proprietăți chimice
Citratul de sodiu este un tampon, ceea ce înseamnă că stabilizează pH-ul, care este o măsură a acidității sau alcalinității unei soluții apoase. Citratul, prin stabilizarea pH-ului, nu permite soluției să se aciduleze sau să alcalinizeze peste anumite valori.
Când există exces de protoni H+ îi ia să-și convertească grupurile -COO- în grupuri -COOH. Viceversa, dacă există multe grupuri OH- renunță la protonii grupelor lor -COOH și îi transformă în -COO-.
Când este transformat de corp, acesta furnizează 3 molecule de HCO3- pentru fiecare moleculă de citrat.
Alte proprietăți
Cristalele sale sunt deliquescente, adică absorb apa din aer. Citratul de sodiu dihidrat este mai stabil în aer.
Dacă dihidratul este încălzit, când ajunge la 150 ° C devine anhidru (fără apă).
La fel ca acidul citric, citratul de sodiu are un gust acru.
Obținerea
Citratul de sodiu se obține de obicei prin adăugarea de carbonat de sodiu la o soluție de acid citric până la încetarea efervescenței. Efervescența se datorează evoluției dioxidului de carbon CODouă:
N / ADouăCO3 + Acid citric → Citrat de sodiu + CODouă↑
Apoi apa este evaporată din soluție pentru a cristaliza produsul.
Poate fi preparat și prin tratarea unei soluții de sulfat de sodiu cu citrat de calciu:
N / ADouăSW4 + Citrat de calciu → Citrat de sodiu + CaSO4↓
Soluția este filtrată pentru a elimina CaSO4 solid care a precipitat. Apoi soluția este concentrată și astfel cristalizează citratul de sodiu.
Locație în natură
Citratul de sodiu este baza conjugată a acidului citric, care este un compus natural găsit în toate organismele vii, deoarece face parte din metabolismul lor, care este mecanismul pentru dezvoltarea energiei în celule..
Aplicații
În industria alimentară
Citratul de sodiu are diverse utilizări în industria alimentară, de exemplu, ca regulator de aciditate, sechestrant, stabilizator, surfactant sau emulgator..
Este folosit în băuturi, deserturi congelate și brânzeturi speciale, printre alte produse.
Permite evitarea coagulării laptelui, de aceea este adăugat în laptele de vacă care este utilizat pentru hrănirea copiilor care alăptează. În acest fel, cheagurile sau cașul greu greu de digerat nu sunt create de stomacul copiilor..

Se folosește pentru a accelera fixarea culorii la porc sau carne de vită vindecată, adică carne care a fost tratată pentru a preveni deteriorarea. Până la 50% acid ascorbic este înlocuit în acestea.

Este, de asemenea, utilizat pentru a preveni coagularea sângelui în carnea proaspătă de vită (cum ar fi fripturile).
În medicină
Este utilizat ca agent alcalinizant, deoarece neutralizează excesul de acid din sânge și urină. Este indicat pentru tratarea acidozei metabolice care apare atunci când organismul produce prea mult acid.
Odată ingerat, ionul citrat devine ion bicarbonat care este un agent alcalinizant sistemic (adică al întregului organism) și, în consecință, ionii H sunt neutralizați.+, crește pH-ul sanguin și inversează sau elimină acidoză.
Citratul de sodiu servește ca agent neutralizant pentru stomacul supărat.
Este folosit ca expectorant și sudorific. Are acțiune diuretică. Crește excreția urinară de calciu, motiv pentru care este utilizată în hipercalcemie, care este atunci când există un exces de calciu în sânge.
De asemenea, servește pentru a facilita îndepărtarea plumbului atunci când are loc otrăvirea cu plumb..
Dacă este administrat în exces, poate provoca alcaloză, spasme musculare din cauza funcționării defectuoase a glandei paratiroide și a depresiei funcției inimii datorită scăderii nivelului de calciu din sânge, printre alte simptome..
Citratul de sodiu este utilizat în transfuzii. Se adaugă în sânge împreună cu dextroză pentru a preveni coagularea acestuia.
În mod normal, ficatul metabolizează rapid citratul obținut în transfuzie, cu toate acestea, în timpul transfuziilor în cantități mari, capacitatea ficatului poate fi depășită..
În astfel de cazuri, deoarece citratul formează un complex cu calciu, rezultă o scădere a ionului de calciu Ca.Două+ în sânge. Acest lucru poate duce la amețeli, tremurături, furnicături etc. Prin urmare, transfuziile trebuie efectuate încet.
În industria farmaceutică
Printre multe alte utilizări este utilizat pentru a preveni întunecarea medicamentelor în care există fier și taninuri.
În analizele de sânge
Este utilizat ca anticoagulant în colectarea sângelui sau atunci când trebuie depozitat, deoarece acționează ca un chelator al ionilor de calciu CaDouă+, adică se leagă de ioni de calciu formând citrat de calciu care nu este ionizat.
Este utilizat în testele de coagulare și în determinarea ratei de sedimentare a globulelor roșii..
Este utilizat ca anticoagulant în timpul plasmaferezei, o procedură pentru îndepărtarea substanțelor în exces care sunt dăunătoare organismului din sânge..
În sinteza nanoparticulelor
Este folosit ca stabilizator în sinteza nanoparticulelor de aur. Citratul trisodic dihidrat este adăugat la acidul cloroauric, formând o suspensie roșie-vin..
Citratul de sodiu servește ca agent de reducere și ca agent antiplachetar, deoarece se adsorbe pe nanoparticule..
Datorită încărcării negative a citratului, particulele se resping reciproc evitând aglomerarea și formând o dispersie stabilă. Cu cât este mai mare concentrația de citrat, cu atât particulele sunt mai mici..
Aceste nanoparticule sunt utilizate pentru a pregăti biosenzori medicali.
În detergenții ecologici
Citratul de sodiu este utilizat pe scară largă în detergenții lichizi fără fosfați. Acest lucru se datorează faptului că comportamentul său de mediu este inofensiv, deoarece este un metabolit găsit în toate organismele vii..
Este ușor biodegradabil și slab toxic pentru viața acvatică. Din acest motiv, este considerat un agent de curățare cu caracteristici ecologice favorabile..
În îmbunătățirea exploatării nisipurilor de gudron
Nisipurile petroliere sunt formațiuni nisipoase bogate în bitum sau gudron, un material similar cu petrolul.
Citratul de sodiu a fost testat cu succes împreună cu hidroxidul de sodiu NaOH pentru a extrage ulei din nisipurile de gudron.
Se crede că prin asocierea citratului cu gresia, ionii -COO- Citratul formează un număr mare de sarcini negative asupra particulelor de silice. Aceasta produce o separare mai bună a nisipului de bitum prin simpla repelență a sarcinilor negative ale pietrișului de sarcinile negative ale bitumului.
În alte aplicații
Se folosește în fotografie, pentru îndepărtarea urmelor de metale, în galvanizare și pentru îndepărtarea SODouă gaze reziduale.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Citrat de sodiu. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Colectarea și manipularea sângelui. În Dacie și Lewis Practical Hematology (Ediția a XII-a). Recuperat de la sciencedirect.com.
- Steber, J. (2007). Ecotoxicitatea ingredientelor produselor de curățat. În Manual pentru curățarea / decontaminarea suprafețelor. Recuperat de la sciencedirect.com.
- Xiang, B. și colab. (2019). Studiul rolului citratului de sodiu în eliberarea bitumului. Combustibili energetici 2019, 33, 8271-8278. Recuperat de la pubs.acs.org.
- Heddle, N. și Webert, K.E. (2007). Medicina transfuzională. În Banca de sânge și medicina transfuzională (ediția a doua). Recuperat de la sciencedirect.com.
- Sudhakar, S. și Santhosh, P.B. (2017). Nanomateriale de aur. În Advances in Biomembranes and Lipid Self-Assembly. Recuperat de la sciencedirect.com.
- Elsevier (editorial) (2018). Capitolul 8. Nanometal. În Fundamentele și aplicațiile nanoziliciului în plasmonică și fullerine. Tendințe actuale și viitoare Tehnologii micro și nano. Pagini 169-203. Recuperat de la sciencedirect.com.



Nimeni nu a comentat acest articol încă.