
Proprietăți, riscuri și utilizări ale clorurii de amoniu (NH4Cl)
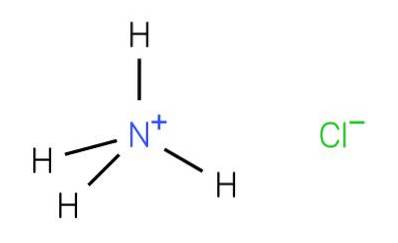
Clorură de amoniu, cunoscută și sub numele de sare de amoniac, este o sare anorganică care se găsește în urină a cărei formulă este NH4Cl. Se găsește în formațiuni mineralogice și sub această formă se numește sare de amoniac. De asemenea, a fost găsit în unele orificii vulcanice și cenușă.
Poate fi obținut prin diferite metode. Primul este prin neutralizarea cu HCI a reziduului de amoniac format în distilarea cărbunelui: NH3 + HCI → NH4Cl.
A doua strategie este prin procesul Solvay de a obține carbonat de sodiu (sau bicarbonat) și unde clorura de amoniu este produsă ca subprodus:
NH3 + CODouă + NaCI + HDouăO → NH4Cl + NaHCO3
În procesul Solvay, bicarbonatul de sodiu este recuperat prin filtrare și apoi cristalizează clorura de amoniu care rămâne în soluție (Formula clorurii de amoniu, S.F.).
Peste 230.000 de tone de clorură de amoniu sunt produse anual în Japonia, unde este utilizată în principal pentru îngrășăminte în cultivarea orezului..
Cu toate acestea, sarea fără miros are multe alte aplicații, inclusiv utilizarea la fabricarea produselor de curățare personale, pirotehnică, ca componentă în industria metalurgică, medicină, ca aromă în industria alimentară și ca electrolit în bateriile de zinc. Chemical Company, 2016).
Indice articol
- 1 Proprietăți fizice și chimice
- 2 Reactivitate și pericole
- 3 utilizări
- 3.1 1- Medicină
- 3.2 2- Îngrășământ
- 3.3 3- Metalurgie
- 3.4 4- Componenta bateriei
- 3.5 5- Mâncare
- 3.6 6- Alte utilizări
- 4 Referințe
Proprietati fizice si chimice
Clorura de amoniu sunt particule albe higroscopice fin divizate și fără miros (Centrul Național pentru Informații despre Biotehnologie., 2017).

Compusul are o structură de rețea triclinică cu o structură cubică centrată pe centru. Greutatea sa moleculară este de 53,490 g / mol, densitatea sa este de 1,5274 g / mL, iar punctele sale de topire și fierbere sunt de 338 ºC și 520 ºC..
Clorura de amoniu este solubilă în apă, fiind capabilă să dizolve 383,0 g de compus pe litru de solvent. De asemenea, este solubil în etanol, metanol și glicerol și ușor solubil în acetonă. Este insolubil în solvenți organici precum acetat de etil (Royal Society of Chemistry, 2015).
Clorura de amoniu poate suferi diferite reacții de mare valoare pentru industria chimică și farmaceutică. Se poate descompune atunci când este încălzit în acid clorhidric și amoniac:
NH4Cl → NH3 + acid clorhidric
În plus, poate reacționa cu baze precum hidroxidul de sodiu sau potasiu pentru a produce, de asemenea, amoniac gazos:
NH4Cl + NaOH → NH3 + NaCI + HDouăSAU
O altă reacție importantă în care se folosește clorura de amoniac este descompunerea carbonaților și a bicarbonaților, formând o sare și amoniac:
2NH4Cl + NaDouăCO3 → 2NaCl + CODouă + HDouăO + 2NH3
Clorura de amoniu este considerată o sare acidă. Soluțiile rezultate conțin concentrații moderate de ioni de hidroniu și au un pH mai mic de 7,0. Reacționează ca acizii pentru a neutraliza bazele.
În general, acestea nu reacționează ca agenți oxidanți sau agenți reducători, dar un astfel de comportament nu este imposibil. Mulți dintre acești compuși catalizează reacțiile organice (clorură de amoniu, 2016).
Reactivitate și pericole
Clorura de amoniu este extrem de otrăvitoare și toxică. Acestea provoacă leziuni ale organelor prin ingestie sau expunere pe termen lung și sunt, de asemenea, dăunătoare pentru ochi. Nu este inflamabil și nu reacționează cu alte substanțe chimice (Institutul Național pentru Securitate și Sănătate în Muncă, 2014).
În caz de contact cu ochii, verificați dacă purtați lentile de contact și scoateți-le imediat. Ochii trebuie spălați cu apă curentă timp de cel puțin 15 minute, ținând pleoapele deschise. Se poate folosi apa rece. Unguentul pentru ochi nu trebuie utilizat.
Dacă substanța chimică intră în contact cu îmbrăcămintea, îndepărtați-o cât mai repede posibil, protejându-vă propriile mâini și corp.
Așezați victima sub un duș de siguranță. Dacă substanța chimică se acumulează pe pielea expusă a victimei, cum ar fi mâinile, pielea contaminată este spălată ușor cu apă curentă și săpun non-abraziv. Se poate folosi apa rece. Dacă iritația persistă, solicitați asistență medicală. Spălați hainele contaminate înainte de a le folosi din nou.
Dacă contactul cu pielea este sever, trebuie spălat cu un săpun dezinfectant și acoperiți pielea contaminată cu o cremă antibacteriană..
În caz de inhalare, victima trebuie lăsată să se odihnească într-o zonă bine ventilată. Dacă inhalarea este severă, victima trebuie evacuată într-o zonă sigură cât mai curând posibil. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul, cămașa sau cravata cămășii.
Dacă victimei îi este greu să respire, trebuie administrat oxigen. Dacă victima nu respiră, se efectuează resuscitarea gură la gură. Ținând cont întotdeauna că poate fi periculos pentru persoana care acordă ajutor să ofere resuscitare gură la gură atunci când materialul inhalat este toxic, infecțios sau coroziv..
În caz de înghițire, nu provocați vărsături. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerele pentru cămăși, curele sau cravate. Dacă victima nu respiră, efectuați resuscitarea gură-la-gură.
În toate cazurile, trebuie solicitată asistență medicală imediată (fișa tehnică de securitate a clorurii de amoniu, 2013).
Aplicații
1- Medicină
Clorura de amoniu are o funcție biochimică foarte importantă: menține pH-ul fiziologic.
Ca sare acidă, poate ajuta la corectarea situațiilor în care concentrația plasmatică a ionilor de clorură este scăzută sau în cazurile de alcaloză din sânge (pH ridicat din sânge). Acest lucru poate apărea după vărsături, aspirație (îndepărtarea) conținutului stomacului, utilizarea diureticelor (pastile de apă sau lichide) sau cu anumite boli de stomac..
Clorura de amoniu provoacă, de asemenea, eliminarea excesului de săruri și apă prin urinarea crescută și provoacă acidoză în urină (o face mai acidă)..
Clorura de amoniu a fost, de asemenea, utilizată pentru a reduce balonarea sau creșterea în greutate care apare înainte de perioadele menstruale și ca ajutor în tratarea infecțiilor tractului urinar (Universitatea din Utah, 2017).
Este o componentă a multor medicamente pentru răceală și tuse datorită eficienței sale ca expectorant. În medicina veterinară este utilizat pentru prevenirea calculilor urinari la capre, bovine și ovine (Encyclopædia Britannica, 2016).
2- Îngrășământ
Clorura de amoniu este utilizată în principal ca sursă de azot în îngrășăminte (care corespunde cu 90% din producția globală a compusului), cum ar fi fosfatul de cloramoniu, în principal pentru culturile de orez și grâu din Asia..
3- Metalurgie
Clorura de amoniu este utilizată ca flux în prepararea metalelor care urmează să fie acoperite cu staniu, galvanizate sau sudate. Funcționează ca un flux prin curățarea suprafeței pieselor prelucrate prin reacția cu oxizii metalici de pe suprafață pentru a forma o clorură de metal volatilă.
Pentru aceasta, este vândut în blocuri în magazinele de hardware pentru a fi utilizat la curățarea vârfului unui fier de lipit și poate fi inclus în lipit sub formă de flux..
4- Componenta bateriei
Clorură de amoniu, NH4Cl, este o componentă a bateriilor cu celule uscate, rezervoare de energie care alimentează dispozitivele electrice. Bateriile vă permit să utilizați electricitatea atunci când nu vă aflați lângă o priză sau o priză electrică.
Există trei componente principale pentru fiecare baterie: un catod (partea superioară a bateriei AA de zi cu zi, din care curg electroni), un anod (partea inferioară a bateriei AA, în care curg electronii) și un electrolit a prin care electronii și ionii se pot mișca.
Când clorura de amoniu este utilizată ca electrolit într-o baterie, aceasta se transformă într-o pastă apoasă și este plasată între catod și anod..
Reacțiile chimice dintre catodii bateriei și anodii determină curgerea electronilor prin pasta de clorură de amoniu, departe de catod și către anod..
Electronii trec prin contactele metalice din compartimentul bateriei, făcând echipamentul electric să funcționeze (American Chemistry Council, Inc, 2005).
5- Mâncare
În mai multe țări, clorura de amoniu, sub denumirea de sare de amoniac sau colocvial salmiakki, este utilizată ca aditiv alimentar sub numărul E E510, de obicei ca nutrient de drojdie în producția de pâine..
Este un supliment alimentar pentru bovine și un ingredient în mediul nutritiv pentru drojdii și multe microorganisme..
Clorura de amoniu este folosită pentru aromatizarea dulciurilor negre numite lemn dulce sărat (foarte popular în țările nordice), la coacere pentru a da cookie-urilor o textură foarte crocantă și în lichiorul Salmiakki Koskenkorva pentru aromă.
În India și Pakistan, se numește „Noshader” și este folosit pentru a spori prospețimea gustărilor precum samamos și jalebi..
6- Alte utilizări
Clorura de amoniu poate fi găsită în șampon, vopsele de păr și înălbitor, spălare și curățare corporală, demachiant facial, balsam, săpun pentru vase, precum și uleiuri și săruri de baie..
Clorura de amoniu este utilizată și la gravare în fabricarea circuitelor imprimate, ca stingător. Este, de asemenea, un ingredient în artificii, explozivi și chibrituri și ca agent de întărire în adezivi pe bază de formaldehidă..
Referințe
- American Chemistry Council, Inc. (2005, mai). Clorură de amoniu: ajutând la furnizarea energiei electrice portabile. Recuperat de la americanchemistry: americanchemistry.com.
- Clorură de amoniu. (2016). Recuperat de la CAMEO Chemicals: cameochemicals.noaa.gov.
- Formula clorurii de amoniu. (S.F.). Recuperat de la softschools: softschools.com.
- EMBL-EBI. (2016, 29 februarie). Clorură de amoniu. Recuperat de la ChEBI: ebi.ac.uk.
- Encyclopædia Britannica. (2016, 13 aprilie). Clorură de amoniu (NH4Cl). Recuperat de la Encyclopædia Britannica: britannica.com.
- Fișă tehnică de securitate a clorurii de amoniu. (2013, 21 mai). Recuperat de la sciencelab: sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 22 aprilie). Baza de date compusă PubChem; CID = 25517. Recuperat de la PubChem: pubchem.ncbi.nlm.nih.gov.
- Societatea Regală de Chimie. (2015). Clorură de amoniu. Recuperat de la chemspider: chemspider.com.
- The Chemical Company. (2016). Clorură de amoniu. Recuperat de la thechemco: thechemco.com.
- Institutul Național pentru Sănătate și Securitate în Muncă. (2014, 1 iulie). CLORURĂ DE AMONIU. Recuperat de pe cdc.gov.
- Universitatea din Utah. (2017). Comprimate acoperite enteric cu clorură de amoniu. Preluat de pe health.utah.edu.


Nimeni nu a comentat acest articol încă.