
Ce sunt orbitalele degenerate?
orbitalele degenerate sunt toți aceia care se află la același nivel de energie. Conform acestei definiții, acestea trebuie să aibă același număr cuantic principal n. Astfel, orbitalele 2s și 2p sunt degenerate, deoarece aparțin nivelului de energie 2. Cu toate acestea, se știe că funcțiile lor de undă unghiulară și radială sunt diferite.
Ca valori ale n, electronii încep să ocupe alte subnivele de energie, cum ar fi orbitalele d și f. Fiecare dintre acești orbitali are propriile caracteristici, care la prima vedere pot fi văzute în formele lor unghiulare; Acestea sunt figurile sferice, gantere (p), trifoi (d) și figuri globulare (f).
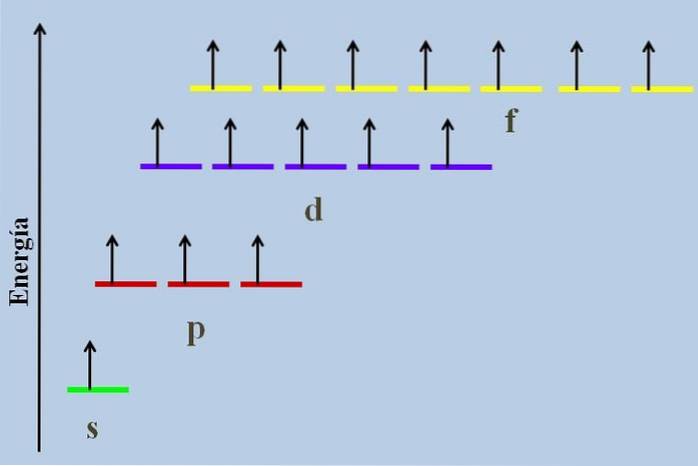
Între ele, există o diferență energetică, chiar dacă aparțin aceluiași nivel n.
De exemplu, imaginea de mai sus prezintă o schemă energetică cu orbitalele ocupate de electroni nepereche (un caz anormal). Se poate observa că dintre toate cele mai stabile (cea cu cea mai mică energie) este orbitalul ns (1s, 2s, ...), în timp ce nf este cel mai instabil (cel cu cea mai mare energie).
Indice articol
- 1 Orbitalele degenerate ale unui atom izolat
- 1.1 Orbitali p
- 1.2 Orbitali d
- 1.3 Orbitali f
- 2 orbitali hibrizi degenerați
- 3 Referințe
Orbitalele degenerate ale unui atom izolat
Orbitalele degenerate, cu aceeași valoare de n, sunt pe aceeași linie într-o schemă energetică. Din acest motiv, cele trei dungi roșii care simbolizează orbitalele p sunt situate pe aceeași linie; la fel și dungile violet și galben în același mod.
Diagrama din imagine încalcă regula lui Hund: orbitalele cu energie superioară sunt umplute cu electroni fără a le asocia mai întâi în cele cu energie inferioară. Pe măsură ce electronii se împerechează, orbitalul pierde energie și exercită o respingere electrostatică mai mare asupra electronilor neperecheați ai celorlalți orbitali..
Cu toate acestea, astfel de efecte nu sunt luate în considerare în multe diagrame energetice. Dacă da, și respectând regula lui Hund fără a umple complet d orbitalii, s-ar vedea că acestea nu mai sunt degenerate.
După cum sa menționat anterior, fiecare orbital are propriile sale caracteristici. Un atom izolat, cu configurația sa electronică, are electronii aranjați în numărul precis de orbitați pentru a-i găzdui. Numai cei egali în energie pot fi considerați degenerați.
Orbitali p
Cele trei dungi roșii pentru orbitalele p degenerate din imagine indică faptul că ambele pX, pDa Și pz posedă aceeași energie. Există un electron nepereche în fiecare, descris prin patru numere cuantice (n, l, ml Da Domnișoară), în timp ce primele trei descriu orbitalii.
Singura diferență dintre ele este notată de momentul magnetic ml, care trasează calea pX pe axa x, pDa pe axa y și pz pe axa z. Toate cele trei sunt la fel, dar diferă doar prin orientările lor spațiale. Din acest motiv, ele sunt întotdeauna trase aliniate în energie, adică degenerate.
Deoarece sunt aceiași, un atom de azot izolat (cu configurație 1sDouă2sDouă2 P3) trebuie să-și mențină cei trei orbitali p degenerați. Cu toate acestea, scenariul energetic se schimbă brusc dacă se ia în considerare un atom de N într-o moleculă sau un compus chimic..
De ce? Pentru că deși pX, pDa Și pz au o energie egală, aceasta poate varia în fiecare dintre ele dacă au medii chimice diferite; adică dacă se leagă de atomi diferiți.
Orbitali d
Există cinci dungi purpurii care denotă orbitalii d. Într-un atom izolat, chiar dacă au electroni împerecheați, acești cinci orbitali sunt considerați degenerați. Cu toate acestea, spre deosebire de orbitalele p, de data aceasta există o diferență semnificativă în formele lor unghiulare.
Prin urmare, electronii săi călătoresc direcții în spațiu, care variază de la o orbitală la alta. Acest lucru cauzează, conform teoria câmpului de cristal, că o perturbare minimă determină o divizarea energiei a orbitalilor; adică cele cinci dungi violete se separă, lăsând un decalaj de energie între ele:
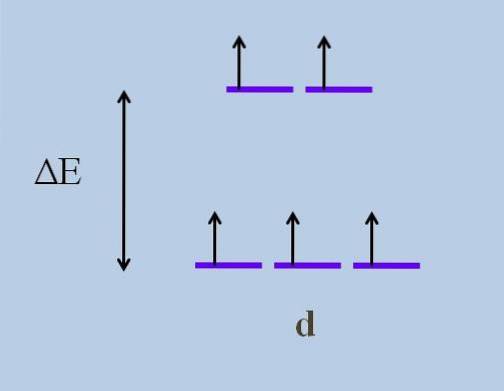
Care sunt orbitalii superiori și care sunt orbitalii inferiori? Cele de mai sus sunt simbolizate ca șig, iar cele de mai jos t2 g. Observați cum inițial toate dungile purpurii erau aliniate, iar acum s-a format un set de doi orbitali șig mai energic decât celălalt set de trei orbitali t2 g.
Această teorie ne permite să explicăm tranzițiile d-d, cărora li se atribuie multe dintre culorile observate în compușii metalelor de tranziție (Cr, Mn, Fe etc.). Și care este cauza acestei perturbări electronice? La interacțiunile de coordonare ale centrului metalic cu alte molecule numite liganzi.
Orbitali f
Și cu orbitalele f, dungile galbene simțite, situația devine și mai complicată. Direcțiile lor spațiale variază foarte mult între ele, iar afișarea legăturilor lor devine prea complexă.
De fapt, orbitalele f sunt considerate a fi atât de acoperite intern încât nu „participă apreciabil” la formarea legăturii..
Când atomul izolat cu f orbitali se înconjoară cu alți atomi, încep interacțiunile și se desfășoară (pierderea degenerării):
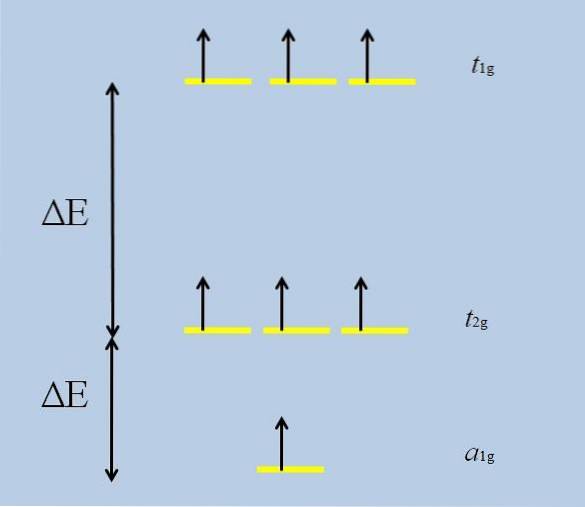
Rețineți că acum dungile galbene formează trei seturi: t1g, t2 g Da la1g, și că nu mai sunt degenerate.
Orbitali hibrizi degenerați
S-a văzut că orbitalii se pot desfășura și pot pierde degenerarea. Cu toate acestea, în timp ce acest lucru explică tranzițiile electronice, acesta pălește în elucidarea modului și de ce există geometrii moleculare diferite. Aici intervin orbitalii hibrizi..
Care sunt principalele sale caracteristici? Că sunt degenerate. Astfel, ele apar din amestecul de caractere ale orbitalilor s, p, d și f, pentru a provoca hibrizi degenerați.
De exemplu, trei orbitali p se amestecă cu un s pentru a da patru orbitali sp3. Toate orbitalele sp3 sunt degenerate și, prin urmare, au aceeași energie.
Dacă suplimentar se amestecă doi d orbitali cu cei patru sp3, veți obține șase orbitale sp3dDouă.
Și cum explică ele geometriile moleculare? Deoarece există șase, cu energii egale, acestea trebuie, prin urmare, să fie orientate simetric în spațiu pentru a genera medii chimice egale (de exemplu, într-un compus MF6).
Când o fac, se formează un octaedru de coordonare, care este egal cu o geometrie octaedrică în jurul unui centru (M).
Cu toate acestea, geometriile sunt adesea distorsionate, ceea ce înseamnă că nici orbitalele hibride nu sunt într-adevăr degenerate complet. Prin urmare, ca o concluzie, orbitalii degenerați există doar în atomi izolați sau în medii extrem de simetrice..
Referințe
- Dicționar Chemicool. (2017). Definiția Degenerate. Recuperat de pe: chemicool.com
- SparkNotes LLC. (2018). Atomi și orbitali atomici. Recuperat de la: sparknotes.com
- Chimie pură. (s.f.). Configurare electronică. Recuperat de pe: es-puraquimica.weebly.com
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Moreno R. Esparza. (2009). Curs de chimie de coordonare: Câmpuri și orbitali. [PDF]. Recuperat de la: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.



Nimeni nu a comentat acest articol încă.