
Caracteristici ale stării solide, proprietăți, tipuri, exemple

stare solidă este unul dintre principalele moduri prin care materia este adăugată pentru a crea corpuri condensate sau solide. Întreaga scoarță terestră, lăsând în afară mările și oceanele, este un conglomerat pestriț de solide. Exemple de obiecte în stare solidă sunt o carte, o piatră sau granule de nisip.
Putem interacționa cu solidele datorită respingerii electronilor noștri cu cei ai atomilor sau moleculelor lor. Spre deosebire de lichide și gaze, atât timp cât nu sunt grav toxice, mâinile noastre nu le pot trece, ci le sfărâmă sau le absorb.

Solidele sunt în general mult mai ușor de manipulat sau depozitat decât un lichid sau un gaz. Cu excepția cazului în care particulele sale sunt fin împărțite, un curent de vânt nu îl va transporta în alte direcții; sunt fixate în spațiul definit de interacțiunile intermoleculare ale atomilor, ionilor sau moleculelor lor.
Indice articol
- 1 Conceptul de solid
- 2 Caracteristicile generale ale solidelor
- 3 Proprietăți
- 3.1 Puncte de topire
- 3.2 Stoichiometrie
- 3.3 Defecte
- 3.4 Reactivitate
- 3.5 Fizic
- 4 Tipuri și exemple
- 4.1 Solidele cristaline
- 4.2 Solidele amorfe
- 4.3 Ionic
- 4.4 Metalic
- 4.5 Atomic
- 4.6 Moleculară și polimerică
- 4.7 Rețele covalente
- 5 Referințe
Concept solid
Solidul este o stare a materiei în care există un volum și o formă rigide; particulele care formează materiale sau obiecte în stare solidă sunt fixate într-un singur loc, nu sunt ușor de comprimat.
Această stare a materiei este cea mai variată și bogată din punct de vedere chimic și fizic. Avem solide ionice, metalice, atomice, moleculare și covalente, fiecare cu propria unitate structurală; adică cu propriile cristale. Când modul lor de agregare nu le permite să stabilească structuri interne ordonate, devin amorfe și complicate.
Studiul stării solide converge în proiectarea și sinteza de noi materiale. De exemplu, lemnul, un solid natural, a fost folosit și ca material ornamental și pentru construcția de case.
Alte materiale solide permit fabricarea de automobile, avioane, nave, nave spațiale, reactoare nucleare, articole sportive, baterii, catalizatori și multe alte obiecte sau produse..
Caracteristicile generale ale solidelor

Principalele caracteristici ale solidelor sunt:
-Au masă, volum și forme definite. Un gaz, de exemplu, nu are un sfârșit sau un început, deoarece acestea depind de containerul care îl stochează..
-Sunt foarte dense. Solidele tind să fie mai dense decât lichidele și gazele; deși există câteva excepții de la regulă, mai ales atunci când se compară lichide și solide.
-Distanțele care separă particulele lor sunt scurte. Aceasta înseamnă că au fost foarte coeziți sau compactați în volumul lor respectiv.

-Interacțiunile lor intermoleculare sunt foarte puternice, altfel nu ar exista ca atare și s-ar topi sau sublima în condiții terestre..

-Mobilitatea solidelor este de obicei destul de limitată, nu doar din punct de vedere material, ci și din punct de vedere molecular. Particulele sale sunt limitate într-o poziție fixă, unde pot doar vibra, dar nu se pot mișca sau roti (în teorie).
Proprietăți
Puncte de topire
Toate solidele, cu excepția cazului în care se descompun în proces și indiferent dacă sunt sau nu conductori buni ai căldurii, pot trece într-o stare lichidă la o anumită temperatură: punctul lor de topire. Când această temperatură este atinsă, particulele sale reușesc în cele din urmă să curgă și să scape din pozițiile lor fixe..
Acest punct de topire va depinde de natura solidului, de interacțiunile sale, de masa molară și de energia rețelei cristaline. De regulă, solidele ionice și rețelele covalente (cum ar fi diamantul și dioxidul de siliciu) tind să aibă cele mai mari puncte de topire; în timp ce solidele moleculare, cel mai mic.
Următoarea imagine arată cum un cub de gheață (stare solidă) se transformă într-o stare lichidă:

Stoichiometrie
O mare parte a solidelor sunt moleculare, deoarece sunt compuși ale căror interacțiuni intermoleculare le permit să se unească în așa fel. Cu toate acestea, multe altele sunt ionice sau parțial ionice, deci unitățile lor nu sunt molecule, ci celule: un set de atomi sau ioni dispuși în mod ordonat..
Aici formulele unor astfel de solide trebuie să respecte neutralitatea sarcinilor, indicând compoziția și relațiile stoichiometrice ale acestora. De exemplu, solidul a cărui formulă ipotetică este ADouăB4SAUDouă subliniază că are același număr de atomi A ca O (2: 2), în timp ce are de două ori numărul de atomi B (2: 4).
Rețineți că indicii cu formula ADouăB4SAUDouă sunt numere întregi, ceea ce arată că este un solid stoichiometric. Compoziția multor solide este descrisă prin aceste formule. Sarcinile A, B și O trebuie să fie egale cu zero, pentru că altfel ar exista o sarcină pozitivă sau negativă.
Pentru solide este deosebit de util să știm cum să le interpretăm formulele, deoarece, în general, compozițiile lichidelor și gazelor sunt mai simple.
Defecte
Structurile solidelor nu sunt perfecte; prezintă imperfecțiuni sau defecte, oricât de cristaline ar fi acestea. Nu este cazul lichidelor sau gazelor. Nu există regiuni de apă lichidă care să poată fi afirmate în prealabil, care să fie „dislocate” în raport cu mediul înconjurător..
Astfel de defecte sunt responsabile pentru soliditatea dură și fragilă, prezentând proprietăți precum piroelectricitatea și piezoelectricitatea sau încetând să aibă compoziții definite; adică sunt solide non-stoichiometrice (de exemplu, A0,4B1.3SAU0,5).
Reactivitate
Solidele sunt de obicei mai puțin reactive decât lichidele și gazele; dar nu din cauza unor cauze chimice, ci a faptului că structurile lor împiedică reactanții să atace particulele din interior, reacționând mai întâi cu cele de pe suprafața lor. Prin urmare, reacțiile care implică solide tind să fie mai lente; dacă nu sunt pulverizate.
Când un solid este sub formă de pulbere, particulele sale mai mici au o suprafață sau o suprafață mai mare pentru a reacționa. De aceea, solidele fine sunt adesea etichetate ca reactivi potențial periculoși, deoarece se pot aprinde rapid sau pot reacționa viguros în contact cu alte substanțe sau compuși..
Solidele sunt adesea dizolvate într-un mediu de reacție pentru a omogeniza sistemul și a efectua o sinteză cu randament mai mare..
Fizic
Cu excepția punctului de topire și a defectelor, ceea ce s-a spus până acum corespunde mai mult proprietăților chimice ale solidelor decât proprietăților fizice ale acestora. Fizica materialelor este profund concentrată asupra modului în care lumina, sunetul, electronii și căldura interacționează cu solidele, fie că sunt cristaline, amorfe, moleculare etc..
Aici intervine ceea ce este cunoscut sub numele de plastic, elastic, rigid, opac, transparent, supraconductor, fotoelectric, microporos, feromagnetic, izolant sau semiconductor..
În chimie, de exemplu, materialele care nu absorb radiațiile ultraviolete sau lumina vizibilă sunt de interes, deoarece sunt utilizate pentru a face celule de măsurare pentru spectrofotometrele UV-Vis. La fel se întâmplă și cu radiațiile infraroșii, atunci când doriți să caracterizați un compus prin obținerea spectrului său IR sau să studiați progresul unei reacții.
Studiul și manipularea tuturor proprietăților fizice ale solidelor necesită o dedicare enormă, precum și sinteza și proiectarea acestora, alegând „bucăți” de construcție anorganică, biologică, organică sau organometalică pentru materiale noi.
Tipuri și exemple
Deoarece există mai multe tipuri de solide chimic, exemplele reprezentative vor fi menționate separat pentru fiecare..
Solidele cristaline
Pe de o parte, există solide cristaline. Aceste elemente sunt caracterizate deoarece moleculele care le alcătuiesc sunt configurate în același mod, care se repetă ca model pe tot cristalul. Fiecare model se numește celulă unitară.
Solidele cristaline se caracterizează și prin faptul că au un punct de topire definit; Aceasta înseamnă că, având în vedere uniformitatea aranjamentului moleculelor sale, există aceeași distanță între fiecare unitate celulară, ceea ce permite întregii structuri să se transforme constant sub aceeași temperatură..
Exemple de solide cristaline pot fi sarea și zahărul..
Solidele amorfe
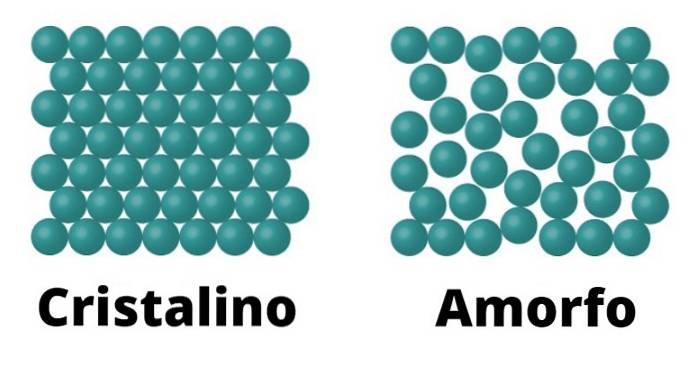
Solidele amorfe sunt caracterizate deoarece conformația moleculelor lor nu răspunde la un model, ci mai degrabă variază pe întreaga suprafață.
Deoarece nu există un astfel de model, punctul de topire al solidelor amorfe nu este definit, spre deosebire de cele cristaline, ceea ce înseamnă că se topește treptat și la temperaturi diferite..
Exemple de solide amorfe pot fi sticla și majoritatea materialelor plastice.
Ionice
Solidele ionice se caracterizează prin faptul că au cationi și anioni, care interacționează între ei prin atracție electrostatică (legare ionică). Când ionii sunt mici, structurile rezultate sunt de obicei întotdeauna cristaline (ținând cont de defectele lor). Printre unele solide ionice avem:
-NaCI (Na+Cl-), clorura de sodiu
-MgO (MgDouă+SAUDouă-), oxid de magneziu
-Hoţ3 (ACDouă+CO3Două-), carbonat de calciu
-CURS4 (CuDouă+SW4Două-), sulfat de cupru
-KF (K+F-), fluorură de potasiu
-NH4Cl (NH4+Cl-), Clorură de amoniu
-ZnS (ZnDouă+SDouă-), sulfură de zinc
-Fe (C6H5GÂNGURI)3, benzoat de fier
Metalic
După cum indică și numele lor, acestea sunt solide care au atomi metalici care interacționează prin legătura metalică:
-Argint
-Aur
-Conduce
-Alamă
-Bronz
-aur alb
-Otel
-Oțeluri
-Duralumin
Rețineți că aliajele contează, de asemenea, ca solide metalice, evident.
Atomic
Solidele metalice sunt, de asemenea, atomice, deoarece teoretic nu există legături covalente între atomii metalici (M-M). Cu toate acestea, gazele nobile contează în esență ca specii atomice, deoarece doar forțele dispersive londoneze predomină printre ele..
Prin urmare, deși nu sunt solide cu aplicare mare (și greu de obținut), gazele nobile cristalizate sunt exemple de solide atomice; adică: heliu, neon, argon, cripton etc., solide.
Moleculare și polimerice
Moleculele pot interacționa prin forțele Van der Walls, unde masele lor moleculare, momentele dipolare, legăturile de hidrogen, structurile și geometriile joacă un rol important. Cu cât aceste interacțiuni sunt mai puternice, cu atât sunt mai probabile ca acestea să fie sub forma unui solid.
Pe de altă parte, același raționament se aplică și polimerilor, care datorită masei lor moleculare medii ridicate sunt aproape întotdeauna solide, iar mai mulți dintre aceștia sunt amorfi; întrucât unităților sale polimerice le este greu să se aranjeze pentru a crea cristale.
Astfel, avem printre unele solide moleculare și polimerice următoarele:
-Gheata uscata

-Zahăr
-Iod
-Acid benzoic
-Acetamidă
-Sulful rombic
-Acid palmitic
-Fullereni
-Meci
-Cofeină
-Naftalină
-Lemn și hârtie
-Mătase
-Teflon
-Polietilena
-Kevlar
-Bachelită
-Clorura de polivinil
-Polistiren
-Polipropilenă
-Proteină
-Ciocolata
Rețele covalente
În cele din urmă, avem rețelele covalente între cele mai dure și cele mai înalte solide de topire. Câteva exemple sunt:
-Grafit
-Diamant
-Cuarţ
-Carbură de siliciu
-Nitrură de bor
-Fosfură de aluminiu
-Arsenid de galiu
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2019). Chimie în stare solidă. Recuperat de pe: en.wikipedia.org
- Elsevier B.V. (2019). Chimie în stare solidă. ScienceDirect. Recuperat de pe: sciencedirect.com
- Dr. Michael Lufaso. (s.f.). Note de lectură de chimie în stare solidă. Recuperat de la: unf.edu
- askIITians. (2019). Caracteristicile generale ale stării solide. Recuperat de pe: askiitians.com
- David Wood. (2019). Cum formează solizi atomii și moleculele: modele și cristale. Studiu. Recuperat de la: study.com



Nimeni nu a comentat acest articol încă.