
Părțile celulei electrolitice, modul în care funcționează și aplicațiile
celulă electrolitică este un mediu în care energia sau curentul electric sunt utilizate pentru a efectua o reacție de reducere a oxidului non-spontană. Se compune din doi electrozi: anodul și catodul.
La anod (+) are loc oxidarea, deoarece la acest loc unele elemente sau compuși pierd electroni; în timp ce în catod (-), reducerea, deoarece în el câțiva elemente sau compuși câștigă electroni.
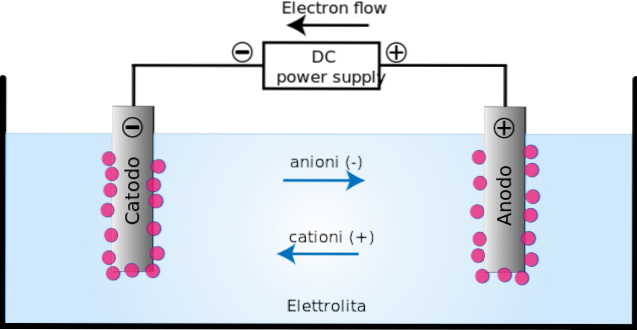
În celula electrolitică, descompunerea unor substanțe, ionizate anterior, are loc printr-un proces cunoscut sub numele de electroliză..
Aplicarea curentului electric produce o orientare în mișcarea ionilor din celula electrolitică. Ionii încărcați pozitiv (cationii) migrează către catodul de încărcare (-).
Între timp, ionii încărcați negativ (anioni) migrează către anodul încărcat (+). Acest transfer de încărcare constituie un curent electric (imaginea de sus). În acest caz, curentul electric este condus de soluții electrolitice, prezente în recipientul celulei electrolitice..
Legea lui Faraday a electrolizei afirmă că cantitatea de substanță care suferă oxidare sau reducere la fiecare electrod este direct proporțională cu cantitatea de electricitate care trece prin celulă sau celulă..
Indice articol
- 1 Piese
- 2 Cum funcționează o celulă electrolitică?
- 2.1 Electroliza clorurii de sodiu topite
- 2.2 Celula descendentă
- 3 Aplicații
- 3.1 Sinteze industriale
- 3.2 Acoperirea și rafinarea metalelor
- 4 Referințe
Părți
O celulă electrolitică este alcătuită dintr-un recipient unde se depune materialul care va suferi reacțiile induse de sarcina electrică..
Containerul are o pereche de electrozi care sunt conectați la o baterie de curent continuu. Electrozii care sunt folosiți de obicei sunt fabricați dintr-un material inert, adică nu participă la reacții.
Un ampermetru poate fi conectat în serie cu bateria pentru a măsura intensitatea curentului care curge prin soluția de electroliți. De asemenea, un voltmetru este plasat în paralel pentru a măsura diferența de tensiune între perechea de electrozi..
Cum funcționează o celulă electrolitică?
Electroliza clorurii de sodiu topite
Se preferă utilizarea clorurii de sodiu topit peste clorură de sodiu solidă, deoarece acesta din urmă nu conduce electricitatea. Ionii vibrează în cristalele voastre, dar nu sunt liberi să se miște.
Reacție catodică
La bornele bateriei sunt conectați electrozi din grafit, un material inert. Un electrod este conectat la borna pozitivă a bateriei, constituind anodul (+).
Între timp, celălalt electrod este conectat la borna negativă a bateriei, constituind catodul (-). Când curentul curge din baterie, se respectă următoarele:
La catod (-) există o reducere a ionului Na+, care la câștigarea unui electron se transformă în Na metalică:
N / A+ + și- => Na (l)
Sodiul metalic alb-argintiu plutește deasupra clorurii de sodiu topit.
Reacția anodică
Dimpotrivă, oxidarea ionului Cl are loc la anod (+)-, deoarece pierde electroni și devine gaz clor (ClDouă), proces care se manifestă prin apariția la anod a unui gaz verde pal. Reacția care apare la anod poate fi conturată după cum urmează:
2Cl- => ClDouă (g) + 2 e-
Formarea gazului Na și Cl metalicDouă de la NaCl nu este un proces spontan, necesitând temperaturi mai mari de 800 ° C pentru ca acesta să se producă. Curentul electric furnizează energia astfel încât transformarea indicată să aibă loc la electrozii celulei electrolitice..
Electronii sunt consumați la catod (-) în procesul de reducere și sunt produși la anod (+) în timpul oxidării. Prin urmare, electronii curg prin circuitul extern al celulei electrolitice de la anod la catod..
Bateria de curent continuu furnizează energia pentru ca electronii să curgă non-spontan de la anod (+) la catod (-).
Down Cell
Celula Down este o adaptare a celulei electrolitice descrisă și utilizată pentru producția industrială de Na metalică și clor gazos..
Celula electrolitică a lui Down are dispozitive care permit colectarea, separat, a gazului metalic de sodiu și clor. Această metodă de producție a sodiului metalic este încă foarte practică.
Odată eliberat prin electroliză, sodiul metalic lichid este drenat, răcit și tăiat în blocuri. Ulterior, este stocat într-un mediu inert, deoarece sodiul poate reacționa exploziv la contactul cu apa sau oxigenul atmosferic..
Clorul gazos este produs în industrie, în principal, prin electroliza clorurii de sodiu într-un proces mai puțin costisitor decât producția de sodiu metalic.
Aplicații
Sinteze industriale
-În industrie, celulele electrolitice sunt utilizate în electrorefinarea și galvanizarea diferitelor metale neferoase. Aproape tot aluminiu, cupru, zinc și plumb de înaltă puritate sunt produse industrial în celule electrolitice..
-Hidrogenul este produs prin electroliza apei. Această procedură chimică este utilizată și în obținerea apei grele (DDouăSAU).
-Metale precum Na, K și Mg sunt obținute prin electroliza electroliților topiți. De asemenea, nemetalele precum fluorurile și clorurile sunt obținute prin electroliză. De asemenea, compuși precum NaOH, KOH, NaDouăCO3 și KMnO4 sunt sintetizate prin același procedeu.
Acoperirea și rafinarea metalelor
-Procesul de acoperire a unui metal inferior cu un metal de calitate superioară este cunoscut sub numele de galvanizare. Scopul este de a preveni coroziunea metalului inferior și de a-l face mai atractiv. Celulele electrolitice sunt utilizate în galvanizarea în acest scop..
-Metalele impure pot fi rafinate prin electroliză. În cazul cuprului, foi de metal foarte subțiri sunt așezate pe catod și tije mari de cupru impur pentru a fi rafinate pe anod.
-Utilizarea articolelor furniriate este comună în societate. Bijuteriile și tacâmurile sunt de obicei placate cu argint; aurul este electrodepozitat pe bijuterii și contacte electrice. Multe obiecte sunt acoperite cu cupru în scopuri decorative.
-Mașinile au aripi din oțel cromat și alte piese. Placarea cromată a barei de protecție a mașinii durează doar 3 secunde de placare cromată pentru a produce o suprafață strălucitoare de 0,0002 mm.
-Electrodepunerea rapidă a metalului produce suprafețe aspre, negre. Electrodepunerea lentă produce suprafețe netede. „Cutiile de tablă” sunt fabricate din oțel acoperit cu tablă prin electroliză. Uneori, aceste cutii sunt cromate într-o fracțiune de secundă cu grosimea stratului de crom extrem de subțire.
Referințe
- Whitten, Davis, Peck și Stanley. Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Pregătire eMedicală. (2018). Aplicații ale electrolizei. Recuperat de pe: emedicalprep.com
- Wikipedia. (2018). Celula electrolitică. Recuperat de pe: en.wikipedia.org
- Prof. Shapley P. (2012). Celulele galvanice și electrolitice. Recuperat de la: butane.chem.uiuc.edu
- Web de cercetare Bodner. (s.f.). Celulele electrolitice. Recuperat de la: chemed.chem.purdue.edu

Nimeni nu a comentat acest articol încă.