
Structura, clasificarea, funcția și importanța degetelor de zinc
degete de zinc (ZF) sunt motive structurale prezente într-un număr mare de proteine eucariote. Acestea aparțin grupului de metaloproteine, deoarece sunt capabile să lege ionul zinc metalic de care au nevoie pentru funcționarea lor. Se estimează că vor exista peste 1.500 de domenii ZF în aproximativ 1.000 de proteine diferite la om..
Termenul deget de zinc sau „deget de zinc” a fost inventat pentru prima dată în 1985 de Miller, McLachlan și Klug, în timp ce studia în detaliu micile domenii de legare a ADN ale factorului transcripțional TFIIIA al Xenopus laevis, descrisă de alți autori cu câțiva ani înainte.
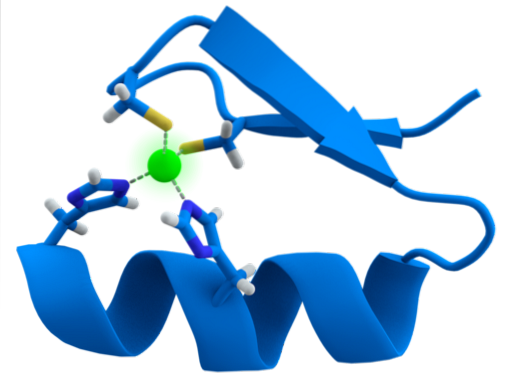
Proteinele cu motive ZF sunt printre cele mai abundente în genomul organismelor eucariote și participă la o varietate de procese celulare esențiale, inclusiv transcrierea genei, traducerea proteinelor, metabolismul, plierea și asamblarea altor proteine și lipide., Moartea celulară programată, printre alții.
Indice articol
- 1 Structură
- 2 Clasificare
- 2.1 C2H2
- 2,2 C2H
- 2.3 C4 (arc sau panglică)
- 2.4 C4 (familia GATA)
- 2,5 C6
- 2.6 Degete de zinc (C3HC4-C3H2C3)
- 2,7 H2C2
- 3 Funcții
- 4 Importanța biotehnologică
- 5 Referințe
Structura
Structura motivelor ZF este extrem de conservată. De obicei, aceste regiuni repetate au 30 până la 60 de aminoacizi, a căror structură secundară se găsește sub forma a două foi beta antiparalele care formează un ac de păr și o helix alfa, care este denumită ββα.
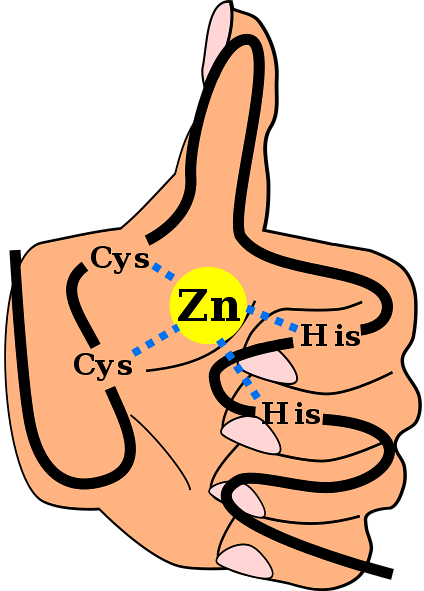
Structura secundară menționată este stabilizată prin interacțiuni hidrofobe și prin coordonarea unui atom de zinc dat de două resturi de cisteină și de două histidină (CysDouăA luiDouă). Cu toate acestea, există ZF-uri care pot coordona mai mult de un atom de zinc și altele în care variază ordinea Cys și a reziduurilor sale..
ZF-urile pot fi găsite repetate în loturi, configurate liniar în aceeași proteină. Toate au structuri similare, dar pot fi diferențiate chimic între ele prin variații ale reziduurilor de aminoacizi cheie pentru îndeplinirea funcțiilor lor.
O caracteristică comună în rândul ZF-urilor este capacitatea lor de a recunoaște molecule de ADN sau ARN de diferite lungimi, motiv pentru care inițial au fost considerați doar ca factori de transcripție.
În general, recunoașterea este a regiunilor de 3bp în ADN și se realizează atunci când proteina cu domeniu ZF prezintă helix alfa în canelura majoră a moleculei de ADN.
Clasificare
Există diferite motive ZF care diferă între ele prin natura lor și configurațiile spațiale diferite realizate de legăturile de coordonare cu atomul de zinc. Una dintre clasificări este după cum urmează:
CDouăHDouă
Acesta este un motiv frecvent întâlnit în ZF-uri. Cele mai multe motive CDouăHDouă Ele sunt specifice pentru interacțiunea cu ADN și ARN, cu toate acestea, s-a observat că participă la interacțiunile proteină-proteină. Au între 25 și 30 de reziduuri de aminoacizi și se găsesc în cea mai mare familie de proteine reglatoare din celulele mamiferelor.
CDouăH
Aceștia interacționează cu ARN și alte proteine. Acestea sunt observate în principal ca parte a unor proteine de retrovirus capsidă, ajutând la ambalarea ARN-ului viral imediat după replicare..
C4 (arc sau panglică)
Proteinele cu acest motiv sunt enzime responsabile de replicarea și transcrierea ADN-ului. Un bun exemplu al acestora pot fi enzimele grosiere ale fagilor T4 și T7.
C4 (Familia GATA)
Această familie ZF cuprinde factori de transcripție care reglează expresia genelor importante în numeroase țesuturi în timpul dezvoltării celulare. Factorii GATA-2 și 3, de exemplu, sunt implicați în hematopoieză.
C6
Aceste domenii sunt tipice pentru drojdii, în special proteina GAL4, care activează transcrierea genelor implicate în utilizarea galactozei și melibiozei..
Degete de zinc (C3HC4-C3HDouăC3)
Aceste structuri particulare posedă 2 subtipuri de domenii ZF (C3HC4 și C3HDouăC3) și sunt prezente în numeroase proteine animale și vegetale.
Acestea se găsesc în proteine precum RAD5, implicate în repararea ADN-ului în organismele eucariote. Ele se găsesc și în RAG1, esențială pentru reconfigurarea imunoglobulinelor.
HDouăCDouă
Acest domeniu al ZF este extrem de conservat în integrazele retrovirusurilor și retrotranspozonilor; prin legarea de proteina țintă provoacă o schimbare conformațională a acesteia.
Caracteristici
Proteinele cu domenii ZF au diverse scopuri: pot fi găsite în proteine ribozomale sau în adaptoare transcripționale. Ele au fost, de asemenea, detectate ca parte integrantă a structurii ARN polimerazei II de drojdie..
Acestea par a fi implicate în homeostazia intracelulară a zincului și în reglarea apoptozei sau a morții celulare programate. În plus, există unele proteine cu ZF care funcționează ca șaperone pentru plierea sau transportul altor proteine..
Legarea de lipide și un rol fundamental în interacțiunile proteină-proteină sunt, de asemenea, funcții proeminente ale domeniilor ZF în unele proteine..
Importanța biotehnologică
De-a lungul anilor, înțelegerea structurală și funcțională a domeniilor ZF a permis mari progrese științifice care implică utilizarea caracteristicilor lor în scopuri biotehnologice..
Deoarece unele proteine cu ZF au o specificitate ridicată pentru anumite domenii ADN, în prezent se investesc mult efort în proiectarea ZF specifice, care pot oferi progrese valoroase în terapia genică la om..
Aplicații biotehnologice interesante apar, de asemenea, din proiectarea proteinelor cu ZF modificate genetic. În funcție de scopul dorit, unele dintre acestea pot fi modificate prin adăugarea de peptide deget "poli zinc", care sunt capabile să recunoască practic orice secvență de ADN cu afinitate și specificitate ridicate..
Editarea genomică modificată prin nucleoză este una dintre cele mai promițătoare aplicații de astăzi. Acest tip de editare oferă posibilitatea de a efectua studii asupra funcției genetice direct în sistemul model de interes..
Ingineria genetică care folosește nucleaze ZF modificate a atras atenția oamenilor de știință în domeniul îmbunătățirii genetice a soiurilor de plante de importanță agronomică. Aceste nucleaze au fost utilizate pentru a corecta o genă endogenă care produce forme rezistente la erbicide în plantele de tutun..
Nucleaze cu ZF au fost, de asemenea, utilizate pentru adăugarea de gene în celulele mamiferelor. Proteinele în cauză au fost utilizate pentru a genera un set de celule izogene de șoarece cu o serie de alele definite pentru o genă endogenă..
Un astfel de proces are o aplicație directă în etichetarea și crearea de noi forme alelice pentru a studia relațiile de structură și funcție în condiții native de expresie și în medii izogene..
Referințe
- Berg, J. M. (1990). Domeniile degetelor de zinc: ipoteze și cunoștințe actuale. Revizuirea anuală a biofizicii și chimiei biofizice, 19(39), 405-421.
- Dreier, B., Beerli, R., Segal, D., Flippin, J. și Barbas, C. (2001). Dezvoltarea domeniilor degetului de zinc pentru recunoașterea familiei 5'-ANN-3 'a secvențelor ADN și utilizarea lor în construcția factorilor de transcripție artificială. JBC, (54).
- Gamsjaeger, R., Liew, C. K., Loughlin, F. E., Crossley, M. și Mackay, J. P. (2007). Degete lipicioase: degete de zinc ca motive de recunoaștere a proteinelor. Tendințe în științe biochimice, 32(2), 63-70.
- Klug, A. (2010). Descoperirea degetelor de zinc și aplicațiile lor în reglarea genelor și manipularea genomului. Revizuirea anuală a biochimiei, 79(1), 213-231.
- Kluska, K., Adamczyk, J. și Krȩzel, A. (2017). Proprietăți de legare a metalelor degetelor de zinc cu un site de legare a metalului modificat în mod natural. Metalomică, 10(2), 248-263.
- Laity, J. H., Lee, B. M. și Wright, P. E. (2001). Proteine deget de zinc: noi perspective asupra diversității structurale și funcționale. Opinia curentă în biologie structurală, unsprezece(1), 39-46.
- Miller, J., McLachlan, A. D. și Klug, A. (1985). Domenii repetitive de legare a zincului în factorul IIIA de transcripție a proteinelor din ovocitele Xenopus. Journal of Trace Elements in Experimental Medicine, 4(6), 1609-1614.
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S. și Gregory, P. D. (2010). Editarea genomului cu nucleaze degetice din zinc. Nature Review Genetica, unsprezece(9), 636-646.



Nimeni nu a comentat acest articol încă.