
Factorii și consecințele denaturării proteinelor

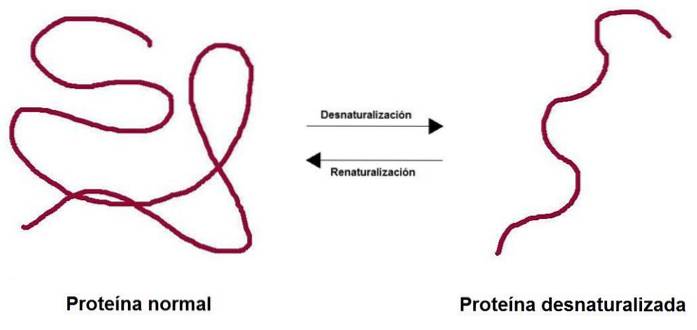
denaturarea proteinelor Acesta constă în pierderea structurii tridimensionale datorită diferiților factori de mediu, cum ar fi temperatura, pH-ul sau anumiți agenți chimici. Pierderea structurii are ca rezultat pierderea funcției biologice asociate acelei proteine, fie ea enzimatică, structurală, transportoare, printre altele..
Structura proteinei este extrem de sensibilă la schimbări. Destabilizarea unei singure legături esențiale de hidrogen poate denatura proteina. În mod similar, există interacțiuni care nu sunt strict esențiale pentru îndeplinirea funcției proteinelor și, dacă sunt destabilizate, nu au niciun efect asupra funcției..
Indice articol
- 1 Structura proteinelor
- 1.1 Structura primară
- 1.2 Structura secundară
- 1.3 Structura terțiară
- 1.4 Structura cuaternară
- 2 Factori care determină denaturarea
- 2,1 pH
- 2.2 Temperatura
- 2.3 Substanțe chimice
- 2.4 Agenți de reducere
- 3 consecințe
- 3.1 Renaturare
- 4 proteine chaperone
- 5 Referințe
Structura proteinelor
Pentru a înțelege procesele de denaturare a proteinelor, trebuie să știm cum sunt organizate proteinele. Acestea prezintă structura primară, secundară, terțiară și cuaternară.
Structura primară
Este secvența de aminoacizi care alcătuiește proteina menționată. Aminoacizii sunt elementele fundamentale care alcătuiesc aceste biomolecule și există 20 de tipuri diferite, fiecare cu proprietăți fizice și chimice speciale. Se leagă între ele printr-o legătură peptidică.
Structura secundară
În această structură, acest lanț liniar de aminoacizi începe să se plieze prin legături de hidrogen. Există două structuri secundare de bază: helixul α, cu formă spirală; și foaia pliată β, când două lanțuri liniare sunt aliniate în paralel.
Structura terțiară
Implică alte tipuri de forțe care duc la pliuri specifice ale formei tridimensionale.
Lanțurile R ale reziduurilor de aminoacizi care alcătuiesc structura proteinelor pot forma punți disulfurice și părțile hidrofobe ale proteinelor se aglomerează la interior, în timp ce cele hidrofile se confruntă cu apa. Forțele van der Waals acționează ca un stabilizator al interacțiunilor descrise.
Structura cuaternară
Constă din agregate de unități proteice.
Când o proteină este denaturată, își pierde structura cuaternară, terțiară și secundară, în timp ce primara rămâne intactă. Proteinele bogate în legături disulfurice (structura terțiară) oferă o rezistență mai mare la denaturare.
Factori care cauzează denaturarea
Orice factor care destabilizează legăturile non-covalente responsabile de menținerea structurii native a proteinei poate provoca denaturarea acesteia. Printre cele mai importante putem menționa:
pH
La valori extrem de extreme ale pH-ului, indiferent dacă sunt acide sau bazice, proteina își poate pierde configurația tridimensională. Excesul de ioni de H+ și OH- la mijloc destabilizează interacțiunile proteice.
Această modificare a modelului ionic determină denaturarea. Denaturarea prin pH poate fi reversibilă în unele cazuri și ireversibilă în altele.
Temperatura
Denaturarea termică are loc odată cu creșterea temperaturii. La organismele care trăiesc în condiții medii de mediu, proteinele încep să se destabilizeze la temperaturi peste 40 ° C. În mod clar, proteinele organismelor termofile pot rezista acestor intervale de temperatură..
Creșterile temperaturii se traduc în mișcări moleculare crescute care afectează legăturile de hidrogen și alte legături necovalente, ducând la pierderea structurii terțiare..
Aceste creșteri ale temperaturii duc la scăderea vitezei de reacție, dacă vorbim despre enzime.
Substanțe chimice
Substanțele polare - cum ar fi ureea - în concentrații mari afectează legăturile de hidrogen. La fel, substanțele nepolare pot avea consecințe similare..
Detergenții pot, de asemenea, să destabilizeze structura proteinelor; cu toate acestea, nu este un proces agresiv și sunt în mare parte reversibile.
Agenți de reducere
Β-Mercaptoetanolul (HOCH2CH2SH) este un agent chimic folosit adesea în laborator pentru denaturarea proteinelor. Este responsabil pentru reducerea punților disulfură între resturile de aminoacizi. Poate destabiliza structura terțiară sau cuaternară a proteinei.
Un alt agent reducător cu funcții similare este ditiotreitolul (DTT). În plus, alți factori care contribuie la pierderea structurii native din proteine sunt metalele grele în concentrații mari și radiațiile ultraviolete..
Consecințe
Când apare denaturarea, proteina își pierde funcția. Proteinele funcționează optim atunci când se află în starea lor nativă.
Pierderea funcției nu este întotdeauna asociată cu un proces de denaturare. S-ar putea ca o mică modificare a structurii proteinei să ducă la pierderea funcției fără a destabiliza întreaga structură tridimensională.
Procesul poate fi sau nu ireversibil. În laborator, dacă condițiile sunt inversate, proteina poate reveni la configurația sa inițială.
Renaturare
Unul dintre cele mai faimoase și concludente experimente privind renaturarea a fost evidențiat în ribonuclează A.
Când cercetătorii au adăugat agenți de denaturare precum ureea sau β-mercaptoetanolul, proteina a fost denaturată. Dacă acești agenți au fost eliminați, proteina a revenit la conformația sa nativă și și-ar putea îndeplini funcția cu o eficiență 100%..
Una dintre cele mai importante concluzii ale acestei cercetări a fost de a demonstra experimental că conformația tridimensională a proteinei este dată de structura sa primară..
În unele cazuri, procesul de denaturare este total ireversibil. De exemplu, când gătim un ou, aplicăm căldură proteinelor (principala este albumina) care îl constituie, albul capătă un aspect solid și albicios. Intuitiv putem concluziona că, chiar dacă îl răcorim, nu va reveni la forma sa inițială.
În majoritatea cazurilor, procesul de denaturare este însoțit de pierderea solubilității. De asemenea, reduce vâscozitatea, rata de difuzie și cristalizează mai ușor..
Proteine chaperone
Proteinele chaperone sau chaperonine sunt însărcinate cu prevenirea denaturării altor proteine. De asemenea, ele reprimă anumite interacțiuni care nu sunt adecvate între proteine pentru a asigura plierea corectă a acestora..
Când temperatura mediului crește, aceste proteine își cresc concentrația și acționează pentru a preveni denaturarea altor proteine. Acesta este motivul pentru care sunt numite și „proteine de șoc termic” sau HSP pentru acronimul său în limba engleză. (Proteine de șoc termic).
Chaperoninele sunt analoage cu o cușcă sau un butoi care protejează proteina de interes din interior.
Aceste proteine care răspund la situații de stres celular au fost raportate în diferite grupuri de organisme vii și sunt foarte conservate. Există diferite clase de chaperonine și sunt clasificate în funcție de greutatea lor moleculară..
Referințe
- Campbell, N. A., și Reece, J. B. (2007). biologie. Panamerican Medical Ed..
- Devlin, T. M. (2004). Biochimie: Manual cu aplicații clinice. Inversat.
- Koolman, J. și Röhm, K. H. (2005). Biochimie: text și atlas. Panamerican Medical Ed..
- Melo, V., Ruiz, V. M. și Cuamatzi, O. (2007). Biochimia proceselor metabolice. Reveniți.
- Pacheco, D. și Leal, D. P. (2004). Biochimie medicală. Editorial Limusa.
- Pena, A., Arroyo, A., Gómez, A. și Tapia, R. (1988). Biochimie. Editorial Limusa.
- Sadava, D. și Purves, W. H. (2009). Viața: Știința biologiei. Panamerican Medical Ed..
- Tortora, G. J., Funke, B. R. și Case, C. L. (2007). Introducere în microbiologie. Panamerican Medical Ed..
- Voet, D., Voet, J. G. și Pratt, C. W. (2007). Bazele biochimiei. Panamerican Medical Ed..

Nimeni nu a comentat acest articol încă.