
Concepte și exemple de divizibilitate chimică

Putem defini divizibilitate în chimie ca proprietate a materiei care permite separarea ei în porțiuni mai mici. Pentru a înțelege conceptul putem da un exemplu.
Dacă luăm o pâine și o tăiem în jumătate din nou, vom ajunge vreodată la un bloc fundamental de materie care nu poate fi împărțit mai departe? Această întrebare a fost în mintea oamenilor de știință și a filosofilor de mii de ani.
Originea și conceptul de divizibilitate chimică
Pentru o lungă perioadă de timp s-a dezbătut dacă materia era formată din particule (ceea ce știm astăzi ca atomi), totuși, ideea generală era că materia era un continuum care putea fi împărțit.
Acest concept răspândit a făcut ca oamenii de știință geniali precum James Clerk Maxwell (din ecuațiile lui Maxwell) și Ludwing Boltzman (din distribuția lui Boltzman) să fie victima ridicolului, care i-a condus pe primul la nebunie și pe celălalt la sinucidere..
În secolul al V-lea î.Hr., filosoful grec Leucipp și discipolul său Democrit au folosit cuvântul atomi pentru a desemna cea mai mică bucată individuală de materie și au propus că lumea nu constă decât în atomi în mișcare..
Această teorie atomică timpurie s-a diferit de versiunile ulterioare prin aceea că a inclus ideea unui suflet uman alcătuit dintr-un tip de atom mai rafinat distribuit pe tot corpul..
Teoria atomică a căzut în declin în Evul Mediu, dar a fost reînviată la începutul revoluției științifice din secolul al XVII-lea..
Isaac Newton, de exemplu, credea că materia constă din „particule solide, masive, dure, impenetrabile și mobile”..
Divizibilitatea poate apărea prin diferite metode, cea mai comună este divizibilitatea prin metode fizice, de exemplu tocat un măr cu un cuțit.
Cu toate acestea, divizibilitatea poate apărea și prin metode chimice în care materia ar fi separată în molecule sau atomi.
10 exemple de divizibilitate chimică
1- Se dizolvă sarea în apă
Când o sare, de exemplu clorura de sodiu, este dizolvată în apă, are loc un fenomen de solvatare în care legăturile ionice ale sării sunt rupte:
NaCl → Na+ + Cl-
Prin dizolvarea unui bob de sare în apă, se va separa în miliarde de ioni de sodiu și clorură în soluție..
2- Oxidarea metalelor într-un mediu acid
Toate metalele, de exemplu magneziu sau zinc, reacționează cu acizi, de exemplu acid clorhidric diluat pentru a da bule de hidrogen și o soluție incoloră de clorură de metal.
Mg + HCI → MgDouă+ +Cl- + HDouă
Acidul oxidează metalul, separând legăturile metalice pentru a obține ioni în soluție (BBC, 2014).
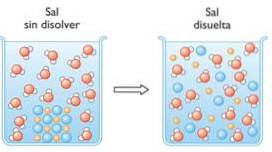
3- Hidroliza esterilor
Hidroliza este ruperea unei legături chimice prin apă. Un exemplu de hidroliză este hidroliza esterilor în care aceștia sunt împărțiți în două molecule, un alcool și un acid carboxilic..
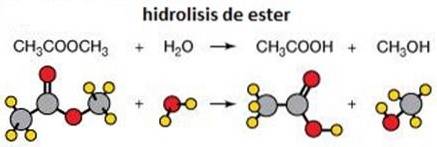
4- Reacții de eliminare
O reacție de eliminare face exact ceea ce spune: elimină atomii dintr-o moleculă. Acest lucru se face pentru a crea o dublă legătură carbon-carbon. Acest lucru se poate face folosind o bază sau un acid.
Poate avea loc într-o singură etapă concertată (extracția protonului la Cα care are loc în același timp cu scindarea legăturii Cβ-X) sau în două etape (scindarea legăturii Cβ-X apare mai întâi pentru a forma un intermediar carbocație, care apoi se „oprește” prin abstractizarea protonului în carbonul alfa).
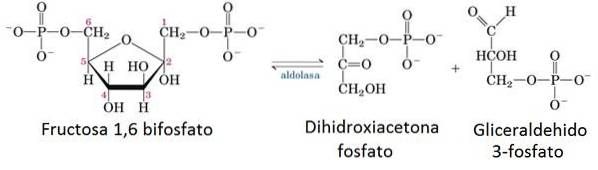
5- Reacția enzimatică a aldolazei
În faza pregătitoare a glicolizei, o moleculă de glucoză este împărțită în două molecule de gliceraldehidă 3-fosfat (G3P) folosind 2 ATP.
Enzima responsabilă de această incizie este aldolaza, care prin condensare inversă împarte în două molecula de fructoză 1,6-bisfosfat dintr-o moleculă G3P și o moleculă de dihidroxiacetonă fosfat care ulterior este izomerizată pentru a forma o altă moleculă de G3P.
6- Degradarea biomoleculelor
Nu numai glicoliza, ci toată degradarea biomoleculelor în reacțiile de catabolism sunt exemple de divizibilitate chimică.
Acest lucru se datorează faptului că pornesc de la molecule mari, cum ar fi carbohidrați, acizi grași și proteine, pentru a produce molecule mai mici, cum ar fi acetil CoA care intră în ciclul Krebs pentru a produce energie sub formă de ATP..
7- Reacții de ardere
Acesta este un alt exemplu de divizibilitate chimică, deoarece moleculele complexe precum propanul sau butanul reacționează cu oxigenul pentru a produce CO.Două si apa:
C3H8 + 5ODouă → 3CODouă + 4HDouăSAU
Se poate spune că degradarea biomoleculelor este o reacție de ardere, deoarece produsele finale sunt CODouă și apă, cu toate acestea acestea sunt date în mai mulți pași cu intermediari diferiți.
8- Centrifugarea sângelui
Separarea diferitelor componente ale sângelui este un exemplu de divizibilitate. Deși este un proces fizic, exemplul mi se pare interesant, deoarece componentele sunt separate de diferența de densitate prin centrifugare.
Componentele cele mai dense, serul cu celulele roșii din sânge, vor rămâne în partea de jos a tubului centrifugii, în timp ce componentele mai puțin dense, plasma, vor rămâne în partea de sus..
9- Tampon bicarbonat
Bicarbonat de sodiu, HCO3- Este principala modalitate de transport a CODouă în organism produs de reacții de degradare metabolică.
Acest compus reacționează cu un proton din mediu pentru a produce acid carbonic care este ulterior împărțit în CO2 și apă:
HCO3- + H+ D HDouăCO3 D CODouă + HDouăSAU
Deoarece reacțiile sunt reversibile, acesta este un mod prin care organismul are, prin respirație, controlul pH-ului fiziologic pentru a evita procesele de alcaloză sau acidoză.
10- Divizarea atomului sau fisiunea nucleară
În cazul în care un nucleu masiv (cum ar fi uraniul-235) se descompune (fisiuni), va rezulta un randament net de energie. Acest lucru se datorează faptului că suma masei fragmentelor va fi mai mică decât masa miezului de uraniu..
În cazul în care masa fragmentelor este egală sau mai mare decât cea a fierului la vârful curbei energiei de legare, particulele nucleare vor fi mai strâns legate decât în nucleul de uraniu și această scădere a masei are loc sub formă de energie în conformitate cu la ecuația lui Einstein.
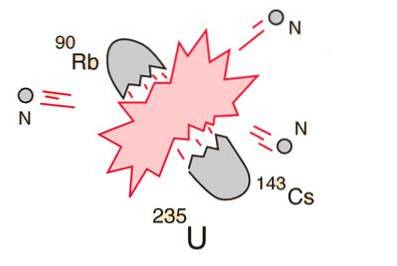
Pentru elementele mai ușoare decât fierul, fuziunea va produce energie. Acest concept a condus la crearea bombei atomice și a energiei nucleare..
Referințe
- AJ Software & Multimedia. (2015). Fisiunea nucleară: elemente de bază. Recuperat de la atomicarchive.com.
- (2014). Reacțiile acizilor. Recuperat de pe bbc.co.uk.
- Clark, J. (2016, ianuarie). ESTERI DE HIDROLIZARE. Recuperat de la chemguide.co.uk.
- Foist, L. (S.F.). Reacții de eliminare în chimia organică. Recuperat de la study.com.
- Miller, W. A. (1867). Elemente de chimie: teoretic și practic, partea 1. New York: John Wiley și fiul său.
- Fisiune nucleara. (S.F.). Recuperat din hiperfizică.
- Pratt, D. (1997, noiembrie). Divizibilitatea infinită a materiei. Recuperat de la davidpratt.info.
- Soderberg, T. (2016, 31 mai). Eliminarea prin mecanismele E1 și E2. Recuperat de la chem.libretext.


Nimeni nu a comentat acest articol încă.