
Părți și exemple de ecuații chimice

ecuație chimică este o reprezentare schematică a unora dintre caracteristicile unei reacții chimice. Se poate spune, de asemenea, că ecuația chimică descrie schimbările experimentate de diferitele substanțe implicate într-o reacție.
Formulele și simbolurile diferitelor substanțe participante sunt plasate în ecuația chimică, indicând clar numărul de atomi ai fiecărui element prezent în compuși, care apare ca un indice și nu poate fi modificat prin echilibrarea ecuației.
Ecuația chimică trebuie să pară echilibrată, adică numărul de atomi ai reactanților și al produselor trebuie să fie egal. În acest fel se respectă legea conservării materiei. Este de dorit ca numerele utilizate la echilibrarea ecuațiilor să fie numere întregi.
Aceste ecuații nu dezvăluie etapele consecutive și nici prin ce mecanisme reactanții sunt transformați în produse..
De aceea, deși sunt foarte utile pentru a înțelege unde se îndreaptă o reacție chimică, nu ne permite să înțelegem aspectele sale moleculare sau cum este afectată de anumite variabile; precum pH-ul, vâscozitatea, timpul de reacție, viteza de agitare, printre altele.
Indice articol
- 1 Părți ale unei ecuații chimice
- 1.1 Amplasarea reactivilor și a produselor
- 1.2 Echilibrarea ecuațiilor chimice
- 1.3 Stări fizice ale componentelor ecuației chimice
- 1.4 Modificări ale stării fizice
- 2 Exemplu de ecuații chimice
- 2.1 - Fotosinteza
- 2.2 - Respirația celulară
- 2.3 - Reacțiile elementelor comune
- 3 Referințe
Părți ale unei ecuații chimice
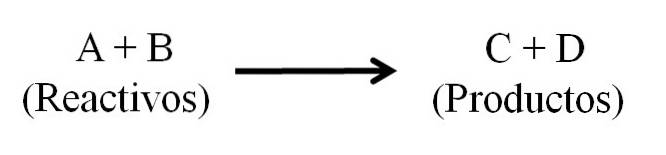
În principiu, există trei părți principale ale unei ecuații chimice: reactanții, produsele și săgeata care indică direcția reacției chimice..
Localizarea reactivilor și a produselor
Toate substanțele care funcționează ca reactanți și toate cele care sunt produse apar în ecuația chimică. Aceste grupuri de substanțe sunt separate de o săgeată care indică direcția reacției. Reactivii sunt localizați în stânga săgeții și produsele în dreapta.
Săgeata înseamnă ceea ce este produs și este orientat de la stânga la dreapta (→), deși în reacțiile reversibile există două săgeți echivalente și paralele; una îndreptată spre dreapta și una spre stânga. Simbolul (Δ) este de obicei plasat deasupra săgeții, indicând faptul că în reacție s-a folosit căldură..
În plus, identificarea catalizatorului este de obicei plasată pe săgeată, dacă este posibil cu formula sau simbolul său. Diferitele substanțe care apar ca reactanți sunt separate prin semnul (+), indicând faptul că substanțele reacționează sau se combină între ele.
În cazul substanțelor care apar ca produse, semnul (+) nu are conotația anterioară; cu excepția cazului în care reacția este reversibilă. Este convenabil ca semnul (+) să fie plasat echidistant de substanțele pe care le separă.
Echilibrarea ecuațiilor chimice
Este o cerință esențială ca ecuațiile chimice să fie echilibrate corespunzător. Pentru aceasta, se plasează un număr numit coeficient stoichiometric. Ori de câte ori este necesar, acest coeficient trebuie să depășească substanțele care apar ca reactanți sau produse..
Acest lucru se realizează astfel încât numărul tuturor atomilor elementelor care apar ca reactanți să fie exact egal cu numărul acestora care apar în produs. Cea mai simplă metodă de echilibrare a ecuațiilor chimice este încercarea și eroarea..
Stări fizice ale componentelor ecuației chimice
În unele ecuații chimice starea fizică a substanțelor este marcată cu un indice. Pentru aceasta, următoarele abrevieri sunt utilizate în spaniolă: (s) pentru starea solidă; (l) pentru starea lichidă; (g), stare gazoasă; și (ac), soluție apoasă.
Exemplu: reacția carbonatului de calciu cu acidul clorhidric.
Hoţ3 (e) + 2 HCI(ac) → CaCl2 (e) + HDouăSAU(l) + CO2 g)
Modificări ale stării fizice
În unele cazuri, este indicat în ecuația chimică dacă există producția unui gaz în reacția chimică sau dacă există precipitarea oricăreia dintre substanțele produse.
Prezența unui gaz este indicată de o săgeată verticală cu capătul îndreptat în sus (↑), plasat pe partea dreaptă a substanței gazoase.
Exemplu: reacția zincului cu acidul clorhidric.
Zn + 2 HCl → ZnClDouă + HDouă↑
Dacă în reacția chimică una dintre substanțe formează un precipitat, acesta este simbolizat prin plasarea unei săgeți verticale cu capătul îndreptat în jos (↓), plasat pe partea dreaptă a substanței precipitate..
Exemplu: reacția acidului clorhidric cu azotatul de argint.
acid clorhidric + AgNO3 → HNO3 + AgCl ↓
Exemplu de ecuații chimice
- Fotosinteză

Fotosinteza este un proces prin care plantele captează și transformă energia luminii, provenind din lumina soarelui, pentru a genera energia necesară pentru subzistența lor. Fotosinteza este realizată de unele organite ale celulelor vegetale numite cloroplaste.
Tilakoidele se găsesc în membrana cloroplastului, locuri în care se găsesc clorofile. la Da b, care sunt principalii pigmenți care captează energia luminii.
Deși fotosinteza este un proces complex, acesta poate fi conturat în următoarea ecuație chimică:
6 CODouă + 6 oreDouăO → C6H12SAU6 + 6 ODouă↑ ΔGº = 2.870 kJ / mol
C6H12SAU6 Este formula glucozei, un carbohidrat metabolizat pentru producerea de ATP; compus care este principalul rezervor de energie în majoritatea ființelor vii. În plus, NADPH este generat din glucoză, o coenzimă necesară pentru multe reacții..
- Respirație celulară
Celulele folosesc oxigenul pentru metabolismul a numeroase substanțe prezente în alimentele ingerate. Între timp, ATP este utilizat ca sursă de energie pentru activitățile desfășurate de ființele vii, producând dioxid de carbon și apă în aceste procese..
Dacă glucoza este utilizată ca model pentru o substanță metabolizată, respirația poate fi schematizată folosind următoarea ecuație chimică:
C6H12SAU6 + 6 ODouă → 6 CODouă + 6 oreDouăSAU
- Reacții comune ale elementelor
Reacție de descompunere
Un compus sau compuși se disociază, formând alți compuși diferiți cu atomii lor:
2 KClO3 (e) → 2 KCl(s) + 3 O2 g)
Reacție de deplasare
Un metal reacționează cu un compus, înlocuind un metal prezent în acesta:
Mg(s) + CURS4 (ac) → Cu(s) + MgSO4 (ac)
Reacție de eliminare
În acest tip de reacție, numărul de atomi sau grupuri atașate unui atom de carbon scade:
CH3-CHDouăBr + NaOH → HDouăC = CHDouă + HDouăO + NaBr
Reacție de hidratare
Este o reacție în care un compus adaugă o moleculă de apă. Această reacție este importantă în prepararea alcoolilor:
HDouăC = CHDouă + HDouăO → HDouăC-CHDouăOh
Reacție de neutralizare
O bază sau un alcalin reacționează cu un acid producând sare și apă:
acid clorhidric(ac) + NaOH(ac) → NaCl(ac) + HDouăSAU(l)
Reacție de sinteză
În acest tip de reacție, două sau mai multe substanțe sunt combinate pentru a crea un nou compus:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Reacție cu dublă deplasare (metateză)
În acest tip de reacție există schimb de ioni pozitivi și negativi pentru a forma noi compuși:
AgNO3 (ac) + NaCI(ac) → AgCl(s) + Frate mai mare3 (ac)
Referințe
- Flores, J. (2002). Chimie. Ediția 1a fost. Editorial Santillana
- Mathews, C. K., Van Holde, K. E. și Ahern, K. G. (2002). Biochimie. 3a fost Ediție. Editura Pearson Addison Wesley
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2019). Ecuația chimică. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (20 septembrie 2019). Ce este o ecuație chimică? Recuperat de pe: thoughtco.com


Nimeni nu a comentat acest articol încă.