
Caracteristici și exemple ale legăturii covalente polare

A legătură covalentă polară Este cel format între două elemente chimice a căror diferență de electronegativitate este substanțială, dar fără a se apropia de un caracter pur ionic. Prin urmare, este o interacțiune intermediară puternică între legăturile covalente apolare și legăturile ionice..
Se spune că este covalent deoarece teoretic există o împărțire egală a unei perechi electronice între cei doi atomi legați; adică cei doi electroni sunt împărțiți în mod egal. Atomul E donează un electron, în timp ce X contribuie cu cel de-al doilea electron pentru a forma legătura covalentă E: X sau E-X.
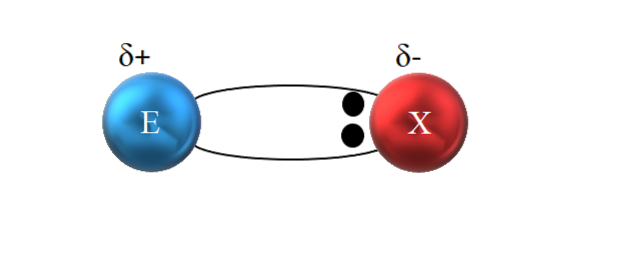
Cu toate acestea, așa cum se vede în imaginea de mai sus, cei doi electroni nu sunt localizați în centrul lui E și X, ceea ce indică faptul că „circulă” cu aceeași frecvență între ambii atomi; mai degrabă sunt mai aproape de X decât de E. Acest lucru înseamnă că X a atras perechea de electroni spre sine din cauza electronegativității sale mai mari.
Deoarece electronii legăturii sunt mai aproape de X decât de E, în jurul valorii de X se creează o regiune cu densitate mare de electroni, δ-; în timp ce în E apare o regiune săracă în electroni, δ +. Prin urmare, există o polarizare a sarcinilor electrice: o legătură covalentă polară.
Indice articol
- 1 Caracteristici
- 1.1 Gradele de polaritate
- 1.2 Elemente chimice care le originează
- 1.3 Caracterul polar și ionic
- 2 Exemple de legături covalente polare
- 2.1 C-O
- 2.2 H-X
- 2,3 O-H
- 2,4 N-H
- 2,5 Fe-O
- 3 Referințe
Caracteristici
Gradele de polaritate
Legăturile covalente sunt foarte abundente în natură. Sunt prezenți în practic toate moleculele eterogene și compușii chimici; întrucât, în cele din urmă, se formează atunci când doi atomi diferiți E și X se leagă. Cu toate acestea, există legături covalente mai polare decât altele și, pentru a afla, trebuie să recurgeți la electronegativități.
Cu cât X este mai electronegativ și cu cât este mai puțin electronegativ E (electropozitiv), atunci legătura covalentă rezultată va fi mai polară. Modul convențional de a estima această polaritate este prin formula:
χX - χȘI
Unde χ este electronegativitatea fiecărui atom în conformitate cu scara Pauling.
Dacă această scădere sau scădere are valori cuprinse între 0,5 și 2, atunci va fi o legătură polară. Prin urmare, este posibil să se compare gradul de polaritate între diferite legături E-X. În cazul în care valoarea obținută este mai mare de 2, vorbim despre o legătură ionică, E+X- Și nu esteδ+-Xδ-.
Cu toate acestea, polaritatea legăturii E-X nu este absolută, ci depinde de mediul molecular; adică într-o moleculă -E-X-, unde E și X formează legături covalente cu alți atomi, aceștia din urmă influențează în mod direct respectivul grad de polaritate.
Elemente chimice care le originează
Deși E și X pot fi orice element, nu toate cauzează legături covalente polare. De exemplu, dacă E este un metal extrem de electropozitiv, cum ar fi cele alcaline (Li, Na, K, Rb și Cs), iar X este un halogen (F, Cl, Br și I), vor tinde să formeze compuși ionici (N / A+Cl-) și fără molecule (Na-Cl).
De aceea legăturile covalente polare se găsesc de obicei între două elemente nemetalice; și într-un grad mai mic, între elementele nemetalice și unele metale de tranziție. Urmărind blocul p din tabelul periodic, aveți multe opțiuni pentru a forma aceste tipuri de legături chimice.
Caracter polar și ionic
În moleculele mari nu este foarte important să ne gândim cât de polară este o legătură; Acestea sunt foarte covalente, iar distribuția sarcinilor lor electrice (acolo unde sunt regiunile bogate sau sărace în electroni) atrage mai multă atenție decât definirea gradului de covalență a legăturilor lor interne..
Cu toate acestea, cu molecule diatomice sau mici, a menționat polaritatea Eδ+-Xδ- este destul de relativ.
Aceasta nu este o problemă cu moleculele formate între elemente nemetalice; Dar când participă metale de tranziție sau metaloizi, nu mai vorbim doar de o legătură covalentă polară, ci de o legătură covalentă cu un anumit caracter ionic; iar în cazul metalelor de tranziție, a unei legături covalente de coordonare dată fiind natura sa.
Exemple de legături covalente polare
CO
Legătura covalentă dintre carbon și oxigen este polară, deoarece prima este mai puțin electronegativă (χC = 2,55) decât a doua (χSAU = 3,44). Prin urmare, când vedem legăturile C-O, C = O sau C-O-, vom ști că sunt legături polare.
H-X
Halogenurile de hidrogen, HX, sunt exemple ideale pentru înțelegerea legăturii polare în moleculele dvs. diatomice. Având electronegativitatea hidrogenului (χH = 2.2), putem estima cât de polare sunt aceste halogenuri între ele:
-HF (H-F), χF (3,98) - χH (2,2) = 1,78
-HCI (H-Cl), χCl (3.16) - χH (2,2) = 0,96
-HBr (H-Br), χFr (2,96) - χH (2,2) = 0,76
-HI (H-I), χEu (2,66) - χH (2,2) = 0,46
Rețineți că, conform acestor calcule, legătura H-F este cea mai polară dintre toate. Acum, care este caracterul său ionic exprimat ca procent, este o altă problemă. Acest rezultat nu este surprinzător, deoarece fluorul este cel mai electronegativ element dintre toate..
Pe măsură ce electronegativitatea cade de la clor la iod, legăturile H-Cl, H-Br și H-I devin, de asemenea, mai puțin polare. Legătura H-I ar trebui să fie apolară, dar este de fapt polară și, de asemenea, foarte „fragilă”; se rupe ușor.
OH
Legătura polară O-H este probabil cea mai importantă dintre toate: datorită ei există viață, deoarece colaborează cu momentul dipol al apei. Dacă estimăm diferența dintre electronegativitățile oxigenului și hidrogenilor, vom avea:
χSAU (3.44) - χH (2,2) = 1,24
Cu toate acestea, molecula de apă, HDouăSau aveți două dintre aceste legături, H-O-H. Aceasta, și geometria unghiulară a moleculei și asimetria acesteia, o fac un compus extrem de polar..
N-H
Legătura N-H este prezentă în grupele amino ale proteinelor. Repetând același calcul avem:
χN (3.04) - χH (2,2) = 0,84
Aceasta reflectă faptul că legătura N-H este mai puțin polară decât O-H (1,24) și F-H (1,78).
Urât
Legătura Fe-O este importantă, deoarece oxizii săi se găsesc în mineralele de fier. Să vedem dacă este mai polar decât H-O:
χSAU (3.44) - χCredinţă (1,83) = 1,61
Prin urmare, se presupune pe bună dreptate că legătura Fe-O este mai polară decât legătura H-O (1,24); sau ceea ce este același lucru cu a spune: Fe-O are un caracter ionic mai mare decât H-O.
Aceste calcule sunt folosite pentru a afla gradele de polaritate dintre diferite legături; dar nu sunt suficiente pentru a determina dacă un compus este ionic, covalent sau caracterul său ionic.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Laura Nappi. (2019). Legături covalente polare și nepolare: definiții și exemple. Studiu. Recuperat de la: study.com
- Helmenstine, Anne Marie, dr. (18 septembrie 2019). Definiția și exemplele legăturii polare (legătura covalentă polară). Recuperat de pe: thoughtco.com
- Elsevier B.V. (2019). Legătura covalentă polară. ScienceDirect. Recuperat de pe: sciencedirect.com
- Wikipedia. (2019). Polaritatea chimică. Recuperat de pe: en.wikipedia.org
- Anonim. (05 iunie 2019). Proprietățile legăturilor covalente polare. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org



Nimeni nu a comentat acest articol încă.