
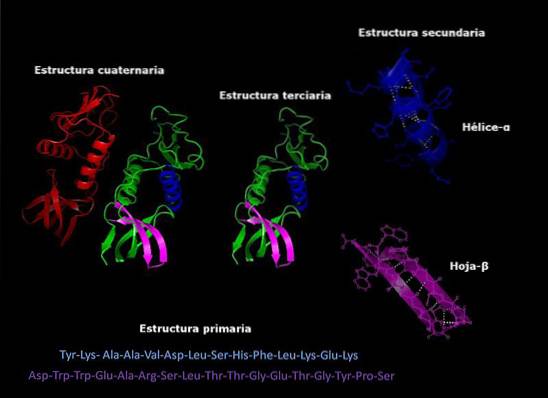
Structura primară a proteinelor caracteristice
structura primară de proteine Este ordinea în care sunt aranjați aminoacizii polipeptidei sau polipeptidelor care le cuprind. O proteină este un biopolimer format din monomeri α-aminoacizi legați prin legături peptidice. Fiecare proteină are o secvență definită a acestor aminoacizi.
Proteinele îndeplinesc o mare varietate de funcții biologice, inclusiv modelarea și menținerea integrității celulelor prin citoschelet, apărarea organismului de agenți străini prin anticorpi și catalizarea reacțiilor chimice din organism prin intermediul enzimelor..
Astăzi, determinarea compoziției proteinelor și ordinea în care sunt aranjați aminoacizii (secvențierea) este mai rapidă decât în urmă cu ani. Aceste informații sunt depozitate în baze de date electronice internaționale, care pot fi accesate prin internet (GenBank, PIR, printre altele).
Indice articol
- 1 Aminoacizi
- 1.1 Aminoacizi alifatici
- 1.2 Aminoacizi cu lanțuri laterale care conțin hidroxil sau sulf
- 1.3 Aminoacizi ciclici
- 1.4 Aminoacizi aromatici
- 1.5 Aminoacizi bazici
- 1.6 Aminoacizi acizi și amidele acestora
- 2 Legături peptidice
- 3 Secvența de aminoacizi
- 4 Codificarea proteinelor
- 5 Referințe
Aminoacizi
Aminoacizii sunt molecule care conțin o grupă amino și o grupă acid carboxilic. În cazul α-aminoacizilor, aceștia au un atom central de carbon (α carbon) de care sunt atașați atât grupa amino cât și grupa carboxil, precum și un atom de hidrogen și o grupare R distinctă, care se numește lanț lateral.
Datorită acestei configurații a α-carbonului, aminoacizii care se formează, cunoscuți sub numele de α-aminoacizi, sunt chirali. Sunt produse două forme care sunt imagini în oglindă și se numesc enantiomeri L și D..
Toate proteinele din ființele vii sunt formate din 20 α-aminoacizi cu configurație L. Lanțurile laterale ale acestor 20 aminoacizi sunt diferite și au o mare diversitate de grupuri chimice.
Practic, α-aminoacizii pot fi grupați (în mod arbitrar) în funcție de tipul lanțului lateral, după cum urmează.
Aminoacizi alifatici
În acest grup sunt conținute, conform unor autori, glicina (Gli), alanina (Ala), Valina (Val), Leucina (Leu) și Isoleucina (Ile). Alți autori includ, de asemenea, Metionina (Met) și Proline (Pro).
Aminoacizi cu lanțuri laterale care conțin hidroxil sau sulf
Conține serină (Ser), cisteină (Cys), treonină (Thr) și, de asemenea, metionină. Potrivit unor autori, grupul ar trebui să includă doar Ser și Thr.
Aminoacizi ciclici
Alcătuit exclusiv din Proline, care, după cum sa menționat deja, este inclus de alți autori printre aminoacizii alifatici.
Aminoacizi aromatici
Fenilalanină (Phe), tirozină (Tyr) și triptofan (Trp).
Aminoacizi bazici
Histidină (His), Lizină (Lys) și Arginină (Arg)
Aminoacizi acizi și amidele acestora
Conține acizi aspartici (Asp) și glutamici (Glu) și amide Aspargină (Asn) și Glutamină (Gln). Unii autori separă acest ultim grup în două; pe de o parte pe cea a aminoacizilor acizi (primii doi), iar pe de altă parte pe cei care conțin carboxilamidă (restul de doi).
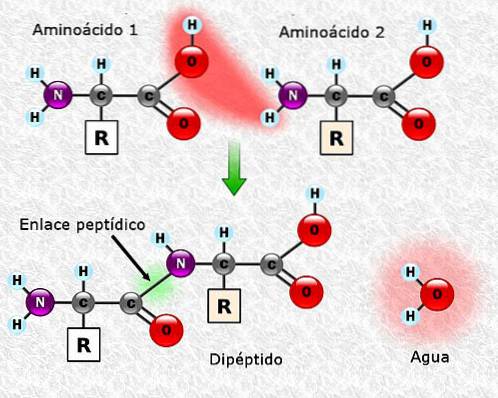
Legături peptidice
Aminoacizii pot fi legați între ei prin intermediul legăturilor peptidice. Aceste legături, numite și legături amidice, se stabilesc între gruparea α-amino a unui aminoacid și gruparea α-carboxil a altuia. Această uniune se formează odată cu pierderea unei molecule de apă.
Unirea dintre doi aminoacizi are ca rezultat formarea unei dipeptide și, dacă se adaugă aminoacizi noi, se pot forma secvențial tripeptide, tetrapeptide și așa mai departe..
Polipeptidele alcătuite dintr-un număr mic de aminoacizi se numesc, în general, oligopeptide și, dacă numărul de aminoacizi este mare, atunci acestea se numesc polipeptide..
Fiecare aminoacid care este adăugat la lanțul polipeptidic eliberează o moleculă de apă. Porțiunea de aminoacid care a pierdut H + sau OH- în timpul unirii, se numește reziduu de aminoacizi.
Majoritatea acestor lanțuri oligopeptidice și polipeptidice vor avea, la un capăt, o grupare amino-terminală (N-terminală), iar la cealaltă un carboxil terminal (C-terminal). În plus, pot conține multe grupuri ionizabile între lanțurile laterale ale reziduurilor de aminoacizi care le formează. Din această cauză, ei sunt considerați poliampoliți.
Secvența de aminoacizi
Fiecare proteină are o anumită secvență a reziduurilor sale de aminoacizi. Această ordine este ceea ce este cunoscut sub numele de structura primară a proteinei..
Fiecare proteină individuală din fiecare organism este specifică speciei. Adică, mioglobina unei ființe umane este identică cu cea a unei alte ființe umane, dar are mici diferențe cu mioglobinele altor mamifere..
Cantitatea și tipurile de aminoacizi pe care le conține o proteină sunt la fel de importante ca și localizarea acestor aminoacizi în lanțul polipeptidic. Pentru a înțelege proteinele, biochimiștii trebuie mai întâi să izoleze și să purifice fiecare proteină, apoi să facă o analiză a conținutului de aminoacizi și, în cele din urmă, să determine secvența acesteia..
Pentru a izola și purifica proteinele există diferite metode, printre care se numără: centrifugarea, cromatografia, filtrarea pe gel, dializa și ultrafiltrarea, precum și utilizarea proprietăților de solubilitate a proteinei în studiu..
Determinarea aminoacizilor prezenți în proteine se efectuează urmând trei etape. Primul este de a rupe legăturile peptidice prin hidroliză. Ulterior, diferitele tipuri de aminoacizi din amestec sunt separate; și în cele din urmă, fiecare dintre tipurile de aminoacizi obținuți este cuantificat.
Pentru a determina structura primară a proteinei, pot fi utilizate diferite metode; dar în prezent cea mai utilizată este metoda Edman, care constă practic în marcarea și separarea în mod repetat a aminoacidului N-terminal de restul lanțului și identificarea fiecărui aminoacid eliberat individual.
Codificarea proteinelor
Structura primară a proteinelor este codificată în genele organismelor. Informațiile genetice sunt conținute în ADN, dar pentru traducerea lor în proteine trebuie mai întâi transcrise în molecule de ARNm. Fiecare triplet de nucleotide (codon) codifică un aminoacid.
Deoarece există 64 de codoni posibili și doar 20 de aminoacizi sunt utilizați în construcția proteinelor, fiecare aminoacid poate fi codificat de mai mult de un codon. Practic toate ființele vii folosesc aceleași codoni pentru a codifica aceiași aminoacizi. Prin urmare, codul genetic este considerat un limbaj aproape universal.
În acest cod, există codoni utilizați pentru a începe și, de asemenea, a opri traducerea polipeptidei. Codonii stop nu codifică niciun aminoacid, ci opresc translația la capătul C-terminal al lanțului și sunt reprezentați de tripletele UAA, UAG și UGA..
Pe de altă parte, codonul AUG funcționează în mod normal ca un semnal de pornire și, de asemenea, coduri pentru metionină..
După traducere, proteinele pot suferi unele prelucrări sau modificări, cum ar fi scurtarea prin fragmentare, pentru a obține configurația lor finală.
Referințe
- C.K. Mathews, K.E. van Holde și K.G. Ahern. 2002. Biochimie. 3a ediție. Benjamin / Cummings Publishing Company, Inc.
- Murray, P. Mayes, D.C. Granner și V.W. Rodwell. 1996. Biochimia lui Harper. Appleton & Lange
- J.M. Berg, J.L. Tymoczko și L. Stryer (nd). Biochimie. 5a ediție. W. H. Freeman and Company.
- J. Koolman și K.-H. Roehm (2005). Atlasul color al biochimiei. Douănd ediție. Thieme.
- A. Lehninger (1978). Biochimie. Ediciones Omega, S.A.
- L. Stryer (1995). Biochimie. W.H. Freeman and Company, New York.



Nimeni nu a comentat acest articol încă.