
Descoperirea reniului, proprietăți, structură, utilizări
reniu Este un element metalic al cărui simbol chimic este Re și este situat în grupa 7 a tabelului periodic, două locuri sub mangan. Împărtășește cu acesta și tehnetium proprietatea de a prezenta mai multe numere sau stări de oxidare, de la +1 la +7. De asemenea, formează un anion numit perrenat, ReO4-, analog cu permanganatul, MnO4-.
Acest metal este unul dintre cele mai rare și rare în natură, astfel încât prețul său este ridicat. Este extras ca produs secundar al extracției molibdenului și cuprului. Una dintre cele mai relevante proprietăți ale reniului este punctul său de topire ridicat, abia depășit de carbon și tungsten, și densitatea sa ridicată, fiind de două ori mai mare decât cea a plumbului..

Descoperirea sa are tonuri controversate și nefericite. Numele „rhenium” derivă din cuvântul latin „rhenus”, care înseamnă Rin, renumitul râu german din apropierea locului în care au lucrat chimiștii germani care au izolat și identificat acest nou element..
Reniul are numeroase utilizări, printre care se evidențiază rafinamentul numărului octanic de benzină, precum și la fabricarea superaliajelor refractare, destinate asamblării turbinelor și motoarelor navelor aerospațiale..
Indice articol
- 1 Descoperire
- 2 Proprietățile reniului
- 2.1 Aspect fizic
- 2.2 Masa molară
- 2.3 Număr atomic
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Electronegativitate
- 2.8 Energii de ionizare
- 2.9 Capacitate termică molară
- 2.10 Conductivitate termică
- 2.11 Rezistivitate electrică
- 2.12 Duritatea Mohs
- 2.13 Izotopi
- 2.14 Reactivitate
- 3 Structură și configurație electronică
- 3.1 numere de oxidare
- 4 utilizări
- 4.1 Benzină
- 4.2 Superaliaje refractare
- 4.3 Filamente de tungsten
- 5 Referințe
Descoperire
Existența a două elemente grele cu caracteristici chimice similare cu cele ale manganului fusese deja prezisă încă din anii 1869, prin tabelul periodic al chimistului rus Dmitri Mendeleev. Cu toate acestea, nu se știa până atunci care ar trebui să fie numerele lor atomice; și aici a fost introdus în 1913 predicția fizicianului englez Henry Moseley.
Potrivit lui Moseley, aceste două elemente aparținând grupului mangan trebuie să aibă numerele atomice 43 și 75.
Cu câțiva ani mai devreme, însă, chimistul japonez Masataka Ogawa a descoperit elementul supus 43 într-un eșantion de torianit mineral. După ce și-a anunțat rezultatele în 1908, a vrut să boteze acest element cu numele „Niponio”. Din păcate, chimiștii de la acea vreme au demonstrat că Ogawa nu descoperise elementul 43..
Și astfel, au trecut alți ani când în 1925 trei chimisti germani: Walter Noddack, Ida Noddack și Otto Berg, au găsit elementul 75 în probe minerale de columbit, gadolinit și molibdenit. Acestea i-au dat numele de reniu, în cinstea râului Rin al Germaniei („Rhenus”, în latină).
Greșeala lui Masataka Ogawa a fost să fi făcut o identificare greșită a elementului: descoperise reniu, nu elementul 43, numit astăzi tehneziu..
Proprietățile reniului
Aspectul fizic
Reniul este de obicei comercializat sub formă de pulbere cenușie. Piesele sale metalice, în general picături sferice, sunt de culoare gri-argintiu, care sunt, de asemenea, foarte strălucitoare..
Masă molară
186,207 g / mol
Numar atomic
75
Punct de topire
3186 ºC
Punct de fierbere
5630 ºC
Densitate
-La temperatura camerei: 21,02 g / cm3
-Chiar la punctul de topire: 18,9 g / cm3
Reniul este un metal care este aproape de două ori mai dens decât plumbul însuși. Astfel, o sferă de reniu care cântărește 1 gram poate fi echivalată cu un cristal de plumb robust de aceeași masă.
Electronegativitate
1.9 pe scara Pauling
Energiile de ionizare
Mai întâi: 760 kJ / mol
În al doilea rând: 1260 kJ / mol
În al treilea rând: 2510 kJ / mol
Capacitatea de căldură molară
25,48 J / (mol K)
Conductivitate termică
48,0 W / (mK)
Rezistență electrică
193 nΩ m
Duritatea lui Mohs
7
Izotopi
Atomii de reniu apar în natură ca doi izotopi: 185Re, cu o abundență de 37,4%; Da 187Re, cu o abundență de 62,6%. Reniul este unul dintre acele elemente al căror izotop cel mai abundent este radioactiv; cu toate acestea, timpul de înjumătățire al 187Re este foarte mare (4.121010 ani), deci este practic considerat stabil.
Reactivitate
Reniul metalic este un material rezistent la rugină. Când o face, se ruginește, ReDouăSAU7, se volatilizează la temperaturi ridicate și arde cu o flacără verde-gălbuie. Bucățile de reniu rezistă atacului HNO3 concentrat; dar când este fierbinte, se dizolvă pentru a genera acid renic și dioxid de azot, ceea ce transformă soluția în maro:
Re + 7HNO3 → HReO4 + 7 NUDouă + 3HDouăSAU
Chimia reniului este vastă, deoarece este capabilă să formeze compuși cu un spectru larg de numere de oxidare, precum și să stabilească o legătură cvadrupolică între doi atomi de reniu (patru legături covalente Re-Re)..
Structura și configurația electronică
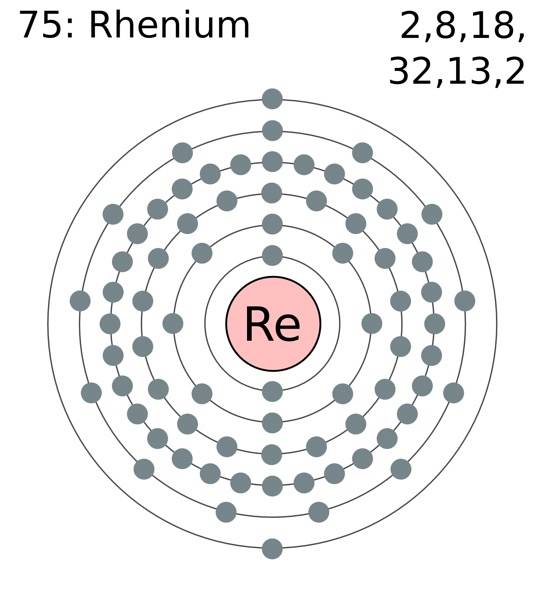
Atomii de reniu se grupează în cristalele lor pentru a forma o structură hexagonală compactă, hcp, care se caracterizează prin faptul că este foarte densă. Acest lucru este în concordanță cu faptul că este un metal de înaltă densitate. Legătura metalică, produsul suprapunerii orbitalilor lor externi, menține atomii de Re puternic coeziți.
În această legătură metalică, Re-Re, participă electronii de valență, care sunt conform configurației electronice:
[Xe] 4f14 5 zile5 6sDouă
În principiu, orbitalele 5d și 6s se suprapun pentru a compacta atomii de Re din structura hcp. Rețineți că electronii săi însumează un total de 7, corespunzător numărului grupului său din tabelul periodic..
Numere de oxidare
Configurația electronică a reniului ne permite să vedem imediat că atomul său este capabil să piardă până la 7 electroni, pentru a deveni cationul ipotetic Re7+. Când se presupune existența Re7+ în orice compus de reniu, de exemplu, în ReDouăSAU7 (ReDouă7+SAU7Două-), se spune că are un număr de oxidare de +7, Re (VII).
Alte numere de oxidare pozitive pentru reniu sunt: +1 (Re+), +2 (ReDouă+), +3 (Re3+) și așa mai departe până la +7. De asemenea, reniul poate câștiga electroni devenind un anion. În aceste cazuri, se spune că are un număr de oxidare negativ: -3 (Re3-), -2 (ReDouă-) și -1 (Re-).
Aplicații
Benzină
Reniul, alături de platină, este utilizat pentru a crea catalizatori care cresc rata octanică a benzinei, reducând în același timp conținutul său de plumb. Pe de altă parte, catalizatorii de reniu sunt utilizați pentru mai multe reacții de hidrogenare, datorită rezistenței lor la otrăvirea cu azot, fosfor și sulf..
Superaliaje refractare
Reniul este un metal refractar datorită punctului său de topire ridicat. De aceea este adăugat la aliajele de nichel pentru a le face refractare și rezistente la presiuni și temperaturi ridicate. Aceste superaliaje sunt utilizate în principal pentru proiectarea turbinelor și a motoarelor pentru navele aerospațiale..
Filamente de tungsten
Reniul poate forma, de asemenea, aliaje cu tungsten, ceea ce îi îmbunătățește ductilitatea și, prin urmare, facilitează fabricarea filamentelor. Aceste filamente de reniu-tungsten sunt utilizate ca surse de raze X și pentru proiectarea de termocupluri capabile să măsoare temperaturi de până la 2200 ° C..
La fel, aceste filamente de reniu au fost folosite odată pentru blițurile camerelor arhaice și acum pentru lămpile echipamentelor sofisticate; precum spectrofotometrul de masă.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Sarah Pierce. (2020). Reniu: utilizări, istorie, fapte și izotopi. Studiu. Recuperat de la: study.com
- Centrul Național pentru Informații despre Biotehnologie. (2020). Reniu. Baza de date PubChem., CID = 23947. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Reniu. Recuperat de pe: en.wikipedia.org
- Dr. Doug Stewart. (2020). Fapte despre elementul reniu. Recuperat de pe: chemicool.com
- Eric Scerri. (18 noiembrie 2008). Reniu. Chimia în elementele sale. Recuperat de pe: chemistryworld.com


Nimeni nu a comentat acest articol încă.