
Cauze, exemple, aplicații și experimente ale tensiunii superficiale
tensiune de suprafata Este o proprietate fizică pe care o prezintă toate lichidele și se caracterizează prin rezistența pe care suprafețele lor o opun oricărei creșteri a zonei lor. Acesta este același lucru cu a spune că suprafața menționată va căuta cea mai mică suprafață posibilă. Acest fenomen împletește mai multe concepte chimice, precum coeziunea, aderența și forțele intermoleculare..
Tensiunea superficială este responsabilă pentru formarea curburilor de suprafață ale lichidelor în recipiente tubulare (cilindri graduali, coloane, eprubete etc.). Acestea pot fi concave (curbate în formă de vale) sau convexe (curbate în formă de cupolă). Multe fenomene fizice pot fi explicate luând în considerare modificările pe care le suferă tensiunea superficială a unui lichid..

Unul dintre aceste fenomene este tendința moleculelor lichide de a se aglomera sub formă de picături, atunci când se sprijină pe suprafețe care le resping. De exemplu, picăturile de apă pe care le vedem deasupra frunzelor, nu o pot uda datorită suprafeței sale ceroase, hidrofobe..
Cu toate acestea, vine un moment în care gravitația își joacă rolul, iar picătura se revarsă ca o coloană de apă. Fenomen similar se produce în picăturile sferice de mercur atunci când este vărsat dintr-un termometru.
Pe de altă parte, tensiunea superficială a apei este cea mai importantă dintre toate, deoarece contribuie și organizează starea corpurilor microscopice în medii apoase, cum ar fi celulele și membranele lipidice ale acestora. În plus, această tensiune este responsabilă de faptul că apa se evaporă încet, iar unele corpuri mai dense decât poate pluti pe suprafața sa..
Indice articol
- 1 Cauzele tensiunii superficiale
- 2 unități
- 3 Tensiunea superficială a apei
- 4 Alte exemple
- 4.1 Gazele condensate
- 4.2 Lichide nepolare
- 4.3 Lichide polare
- 5 Aplicații
- 5.1 Detergenți
- 5.2 Emulsii
- 6 experimente simple
- 6.1 Experiment clip
- 6.2 Barcă de hârtie
- 7 Referințe
Cauzele tensiunii superficiale
Explicația fenomenului de tensiune superficială este la nivel molecular. Moleculele unui lichid interacționează între ele, în așa fel încât să fie coezive în mișcările lor neregulate. O moleculă interacționează cu vecinii săi de lângă ea și cu cei de deasupra sau de dedesubt.
Totuși, acest lucru nu se întâmplă la fel cu moleculele de pe suprafața lichidului, care sunt în contact cu aerul (sau orice alt gaz) sau cu un solid. Moleculele de la suprafață nu pot coezi cu cele din mediul extern.
Drept urmare, ei nu experimentează nicio forță care să-i tragă în sus; numai în jos, de la vecinii săi în mediu lichid. Pentru a contracara acest dezechilibru, moleculele de suprafață „se strâng”, deoarece numai așa pot depăși forța care le împinge în jos.
Apoi se creează o suprafață în care moleculele sunt într-un aranjament mai tensionat. Dacă o particulă dorește să pătrundă în lichid, trebuie să traverseze mai întâi această barieră moleculară proporțională cu tensiunea superficială a lichidului menționat. Același lucru se aplică unei particule care dorește să scape în mediul extern din adâncurile lichidului..
Prin urmare, suprafața sa se comportă ca și cum ar fi un film elastic care prezintă rezistență la deformare..
Unități
Tensiunea superficială este de obicei reprezentată de simbolul γ și este exprimată în unități N / m, forță ori lungime. Cu toate acestea, de cele mai multe ori unitatea sa este din / cm. Unul poate fi convertit în celălalt prin următorul factor de conversie:
1 dyn / cm = 0,001 N / m
Tensiunea superficială a apei
Apa este cea mai rară și uimitoare dintre toate lichidele. Tensiunea sa superficială, precum și câteva dintre proprietățile sale, sunt neobișnuit de mari: 72 dyn / cm la temperatura camerei. Această valoare poate crește la 75,64 dyn / cm, la o temperatură de 0 ° C; sau scade la 58,85 ºC, la o temperatură de 100 ºC.
Aceste observații au sens atunci când considerați că bariera moleculară se strânge și mai mult la temperaturi apropiate de îngheț, sau se „slăbește” puțin mai mult în jurul punctului de fierbere..
Apa are o tensiune superficială ridicată datorită legăturilor sale de hidrogen. Dacă acestea în sine sunt vizibile în interiorul lichidului, sunt cu atât mai mult la suprafață. Moleculele de apă sunt puternic încurcate, formând interacțiuni de tip H dipol-dipol.DouăOH OH.

Eficiența interacțiunilor lor este atât de mare încât bariera moleculară apoasă poate susține chiar și unele corpuri înainte de a se scufunda. În secțiunile aplicații și experimente, acest punct va fi reluat.
Alte exemple
Toate lichidele prezintă tensiuni de suprafață, fie într-un grad mai mic sau mai mare decât apa, fie că sunt substanțe sau soluții pure. Cât de puternice și tensionate sunt barierele moleculare ale suprafețelor sale, va depinde direct de interacțiunile lor intermoleculare, precum și de factorii structurali și energetici..
Gazele condensate
De exemplu, moleculele de gaze în stare lichidă interacționează între ele numai prin intermediul forțelor dispersive londoneze. Acest lucru este în concordanță cu faptul că tensiunile lor superficiale au valori scăzute:
-Heliu lichid, 0,37 dyn / cm la -273 ºC
-Azot lichid, 8,85 dyn / cm la -196 ºC
-Oxigen lichid, 13,2 dyn / cm la -182 ºC
Tensiunea superficială a oxigenului lichid este mai mare decât cea a heliului, deoarece moleculele sale au o masă mai mare..
Lichide apolare
Se așteaptă ca lichidele nepolare și organice să aibă tensiuni de suprafață mai mari decât aceste gaze condensate. Printre unele dintre ele avem următoarele:
-Dietil eter, 17 dyn / cm la 20 ° C
-n-Hexan, 18,40 din / cm la 20 ° C
-n-Octan, 21,80 dyn / cm la 20 ° C
-Toluen, 27,73 dyn / cm la 25 ° C
O tendință similară este observată pentru aceste lichide: tensiunea superficială crește odată cu creșterea masei lor moleculare. Însă n-În conformitate cu aceasta, octanul ar trebui să aibă cea mai mare tensiune superficială și nu toluen. Aici intră în joc structurile și geometriile moleculare.
Moleculele de toluen, plate și inelare, au interacțiuni mai eficiente decât cele ale n-octan. Prin urmare, suprafața toluenului este "mai strânsă" decât suprafața n-octan.
Lichide polare
Deoarece există interacțiuni mai puternice dipol-dipol între moleculele unui lichid polar, tendința lor este de a arăta tensiuni de suprafață mai mari. Dar acest lucru nu este întotdeauna cazul. Printre câteva exemple avem:
-Acid acetic, 27,60 dyn / cm la 20 ° C
-Acetonă, 23,70 dyn / cm la 20 ° C
-Sânge, 55,89 dyn / cm la 22 ° C
-Etanol, 22,27 din / cm la 20 ° C
-Glicerol, 63 dyn / cm la 20 ° C
-Clorură de sodiu topită, 163 dyn / cm la 650 ° C
-Soluție NaCl 6 M, 82,55 dyn / cm la 20 ° C
Se așteaptă ca clorura de sodiu topită să aibă o tensiune superficială enormă: este un lichid vâscos, ionic..
Pe de altă parte, mercurul este unul dintre lichidele cu cea mai mare tensiune superficială: 487 dyn / cm. În ea, suprafața sa este compusă din atomi de mercur puternic coeziți, mult mai mult decât pot fi moleculele de apă..
Aplicații

Tensiunea superficială singură nu are aplicații. Cu toate acestea, acest lucru nu înseamnă că nu este implicat în diferite fenomene zilnice, care, dacă nu ar exista, nu ar avea loc..
De exemplu, țânțarii și alte insecte sunt capabile să meargă prin apă. Acest lucru se datorează faptului că picioarele lor hidrofobe resping apa, în timp ce masa lor redusă le permite să rămână pe linia de plutire pe bariera moleculară fără a cădea pe fundul râului, lacului, iazului etc..
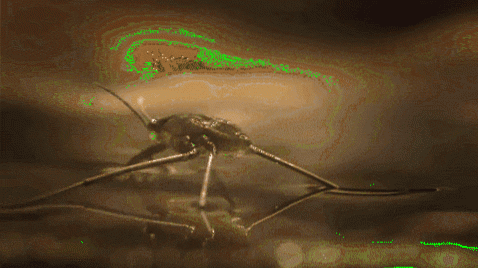
Tensiunea superficială joacă, de asemenea, un rol în umectarea lichidelor. Cu cât tensiunea sa superficială este mai mare, cu atât tendința sa de a se infiltra prin pori sau fisuri într-un material este mai mică. În plus, acestea nu sunt lichide foarte utile pentru curățarea suprafețelor.
Detergenți
Aici acționează detergenții, reducând tensiunea superficială a apei și ajutându-l să acopere suprafețe mai mari; îmbunătățind în același timp acțiunea sa de degresare. Prin scăderea tensiunii sale superficiale, face loc moleculelor de aer, cu care formează bule..
Emulsii
Pe de altă parte, tensiunile scăzute mai mari sunt legate de stabilizarea emulsiilor, care sunt foarte importante în formularea unei game diferite de produse..
Experimente simple

În cele din urmă, vor fi citate câteva experimente care pot fi efectuate în orice spațiu intern..
Clip experiment
O clemă metalică este plasată pe suprafața sa într-un pahar cu apă rece. După cum se vede în imaginea de mai sus, clema va rămâne pe linia de plutire datorită tensiunii superficiale a apei. Dar dacă adăugați un pic de lava de faianță la sticlă, tensiunea superficială va scădea dramatic și agrafa se va lăsa brusc..
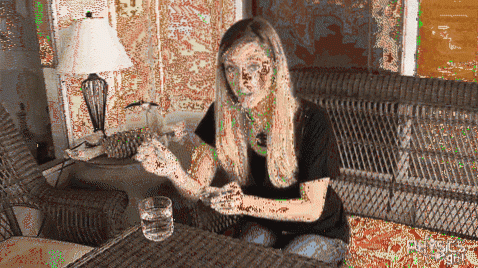
Barcă de hârtie
Dacă la suprafață avem o barcă de hârtie sau un palet de lemn și dacă mașina de spălat vase sau detergentul se adaugă la capul unui tampon, atunci va apărea un fenomen interesant: va exista o respingere care le va propaga spre marginile sticlă. Barca de hârtie și paletul de lemn se vor îndepărta de tamponul murdar de detergent.

Un alt experiment similar și mai grafic constă în repetarea aceleiași operații, dar într-o găleată de apă stropită cu piper negru. Particulele de piper negru se vor îndepărta, iar suprafața se va schimba de la piper acoperit la clar, cu piperul pe margini.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2020). Tensiune de suprafata. Recuperat de pe: en.wikipedia.org
- USGS. (s.f.). Tensiunea suprafeței și apa. Recuperat de la: usgs.gov
- Jones, Andrew Zimmerman. (12 februarie 2020). Tensiunea suprafeței - definiție și experimente. Recuperat de pe: thoughtco.com
- Susanna Laurén. (2017, 15 noiembrie). De ce este importantă tensiunea superficială? Biolin Scientific. Recuperat de pe: blog.biolinscientific.com
- Rookie Parenting Science. (07 noiembrie 2019). Ce este tensiunea superficială | Experiment științific cool. Recuperat de pe: rookieparenting.com
- Jessica Munk. (2020). Experimente de tensiune la suprafață. Studiu. Recuperat de la: study.com
- Copilul ar trebui să vadă asta. (2020). Șapte experimente de tensiune superficială - Fată fizică. Recuperat de pe: thekidshouldseethis.com



Nimeni nu a comentat acest articol încă.