
Proprietăți de etilen glicol, structură chimică, utilizări
etilen glicol este cel mai simplu compus organic din familia glicolului. Formula sa chimică este CDouăH6SAUDouă, în timp ce formula sa structurală este HOCHDouă-CHDouăOH. Un glicol este un alcool caracterizat prin faptul că are două grupări hidroxil (OH) atașate la doi atomi de carbon vecini într-un lanț alifatic.
Etilenglicolul este un lichid limpede, incolor și inodor. În imaginea de mai jos aveți o mostră de el într-un borcan. În plus, are un gust dulce și este foarte higroscopic. Este un lichid ușor volatil, deci exercită o presiune de vapori foarte mică, densitatea vaporilor fiind mai mare decât densitatea aerului..

Etilenglicolul este un compus cu o solubilitate mare în apă, pe lângă faptul că este miscibil cu mulți compuși organici; precum alcooli alifatici cu lanț scurt, acetonă, glicerol etc. Acest lucru se datorează capacității lor de a dona și accepta legături de hidrogen de la solvenți protici (care au H).
Etilenglicolul polimerizează în mulți compuși, ale căror nume sunt adesea prescurtate în PEG și un număr care indică greutatea lor moleculară aproximativă. PEG 400, de exemplu, este un polimer lichid relativ mic. În timp ce PEG-urile mari sunt solide albe cu aspect gras.
Proprietatea etilen glicolului de a deprima punctul de topire și de a crește punctul de fierbere al apei, permite utilizarea acestuia ca agent de răcire și anticoagulant în vehicule, avioane și echipamente de calculator.
Indice articol
- 1 Proprietăți
- 1.1 Denumiri
- 1.2 Masa molară
- 1.3 Aspect fizic
- 1.4 Miros
- 1.5 Aromă
- 1.6 Densitate
- 1.7 Punct de topire
- 1.8 Punctul de fierbere
- 1.9 Solubilitatea în apă
- 1.10 Solubilitate în alți solvenți
- 1.11 Punct de aprindere
- 1.12 Densitatea vaporilor
- 1.13 Presiunea vaporilor
- 1.14 Descompunerea
- 1.15 Temperatura de depozitare
- 1.16 Căldura de ardere
- 1.17 Căldura de vaporizare
- 1.18 Tensiunea superficială
- 1.19 Indicele de refracție
- 1.20 Constanta de disociere
- 1,21 pH
- 1.22 Coeficientul de partiție octanol / apă
- 2 Structura chimică
- 3 Producție
- 3.1 Oxidarea etilenei
- 3.2 Hidroliza oxidului de etilenă
- 3.3 Procesul Omega
- 4 utilizări
- 4.1 Lichid de răcire și antigel
- 4.2 Deshidratare
- 4.3 Fabricarea polimerilor
- 4.4 Explozivi
- 4.5 Protecția lemnului
- 4.6 Alte aplicații
- 5 otrăvire și riscuri
- 5.1 Simptome de expunere
- 5.2 Deteriorarea prin ingestie
- 5.3 Consecințele ecologice ale etilenglicolului
- 6 Referințe
Proprietăți
Numele
Etan-1,2-diol (IUPAC), etilen glicol, monoetilen glicol (MEG), 1-2-dihidroxietan.
Masă molară
62,068 g / mol
Aspectul fizic
Lichid limpede, incolor și vâscos.
Miros
Toaletă
Gust
Bomboane
Densitate
1,1132 g / cm3
Punct de topire
-12,9 ºC
Punct de fierbere
197,3 ºC
Solubilitatea apei
Miscibil cu apă, compus foarte higroscopic.
Solubilitate în alți solvenți
Miscibil cu alcooli alifatici inferiori (metanol și etanol), glicerol, acid acetic, acetonă și cetone similare, aldehide, piridină, baze de gudron de cărbune și solubile în eter. Practic insolubil în benzen și omologii acestuia, hidrocarburi clorurate, eter de petrol și uleiuri.
punctul de aprindere
111 ºC
Densitatea vaporilor
2.14 în raport cu aerul luat ca 1.
Presiunea de vapori
0,092 mmHg la 25 ° C (prin extrapolare).
Descompunere
Când este încălzit până la descompunere, emite fum acru și iritant.
Temperatura de depozitare
2-8 ºC
Căldura de ardere
1,189,2 kJ / mol
Căldura de vaporizare
50,5 kJ / mol
Tensiune de suprafata
47,99 mN / m la 25 ° C
Indicele de refracție
1,4318 la 20 ° C
Constanta de disociere
pKa = 14,22 la 25 ° C
pH
6 până la 7,5 (100 g / L de apă) la 20 ° C
Coeficientul de partiție octanol / apă
Jurnal P = - 1,69
Structura chimică
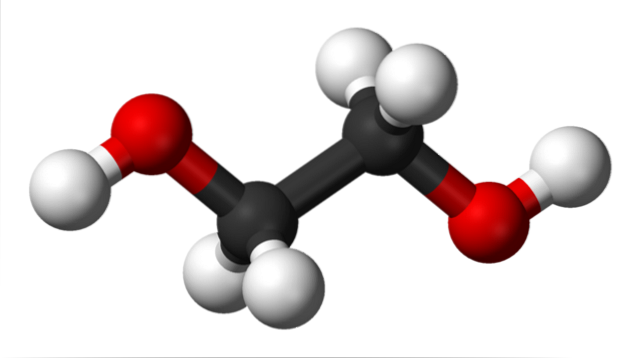
În imaginea superioară avem molecula de etilen glicol reprezentată de un model de sfere și bare. Sferele negre corespund atomilor de carbon, care alcătuiesc scheletul lor C-C, iar la capetele lor avem sferele roșii și albe pentru atomii de oxigen și respectiv de hidrogen..
Este o moleculă simetrică și la prima vedere se poate crede că are un moment dipol permanent; cu toate acestea, legăturile lor C-OH se rotesc, ceea ce favorizează dipolul. Este, de asemenea, o moleculă dinamică, care suferă rotații și vibrații constante și este capabilă să formeze sau să primească legături de hidrogen datorită celor două grupări OH ale sale..
De fapt, aceste interacțiuni sunt responsabile pentru etilenglicolul având un punct de fierbere atât de ridicat (197 ° C).
Când temperatura scade la -13 ºC, moleculele se unesc într-un cristal ortorombic, unde rotamerele joacă un rol important; adică există molecule care au grupările lor O-H orientate în direcții diferite.
Producție
Oxidarea etilenei
Pasul inițial în sinteza etilenglicolului este oxidarea etilenei la oxid de etilenă. În trecut, etilena a reacționat cu acidul hipocloros pentru a produce clorhidrină. Acesta a fost apoi tratat cu hidroxid de calciu pentru a produce oxid de etilenă..
Metoda clorhidrinei nu este foarte profitabilă și s-a trecut la o metodă de oxidare directă a etilenei în prezența aerului sau a oxigenului, folosind oxidul de argint drept catalizator..
Hidroliza oxidului de etilenă
Hidroliza oxidului de etilenă (EO) cu apă sub presiune produce un amestec brut. Amestecul de apă-glicol este evaporat și reciclat, separând monoetilen glicolul de dietilen glicol și trietilen glicol prin distilare fracționată..
Reacția de hidroliză a oxidului de etilenă poate fi conturată după cum urmează:
CDouăH4O + HDouăO => OH-CHDouă-CHDouă-OH (etilen glicol sau monoetilen glicol)
Mitsubishi Chemical a dezvoltat un proces catalitic, prin utilizarea fosforului, în conversia oxidului de etilenă în monoetilen glicol.
Procesul Omega
În procesul Omega, oxidul de etilenă este inițial transformat în etilen carbonat, prin reacția sa cu dioxidul de carbon (CODouă). Apoi, etilen carbonatul este supus unei hidrolize catalitice pentru a obține monoetilen glicolul cu selectivitate 98%.
Există o metodă relativ nouă pentru sinteza etilenglicolului. Aceasta constă în carbonilarea oxidativă a metanolului în dimetil oxalat (DMO) și hidrogenarea ulterioară a acestuia în etilen glicol..
Aplicații
Lichid de răcire și antigel
Amestecul de etilen glicol cu apă permite o scădere a punctului de îngheț și o creștere a punctului de fierbere, permițând motoarelor auto să nu înghețe în timpul iernii și nici să se supraîncălzească vara.
Când procentul de etilen glicol din amestecul cu apă atinge 70%, punctul de îngheț este de -55 ° C, astfel amestecul de etilen glicol-apă poate fi utilizat ca lichid de răcire și protecție împotriva înghețului în acele condiții în care poate apărea.
Temperaturile scăzute de îngheț ale soluțiilor de etilen glicol permit utilizarea acestuia ca antigel în motoarele auto; dezghețarea aripilor aeronavelor; și în degivrarea parbrizelor.
De asemenea, este utilizat pentru conservarea probelor biologice conservate la temperaturi scăzute, evitându-se astfel formarea cristalelor care pot deteriora structura probelor..
Punctul de fierbere ridicat permite utilizarea soluțiilor de etilen glicol pentru menținerea temperaturilor scăzute în dispozitivele sau echipamentele care generează căldură atunci când funcționează, cum ar fi: automobile, echipamente pentru computere, aparate de aer condiționat etc..
Deshidratare
Etilenglicolul este un compus foarte higroscopic, care a permis utilizarea sa pentru tratarea gazelor extrase din subsol care au un conținut ridicat de vapori de apă. Eliminarea apei din gazele naturale favorizează utilizarea lor eficientă în procesele lor industriale respective..
Fabricarea polimerilor
Etilenglicolul este utilizat pentru sinteza polimerilor, cum ar fi polietilen glicol (PEG), polietilen tereftalat (PET) și poliuretan. PEG-urile sunt o familie de polimeri utilizați în aplicații precum: îngroșarea alimentelor, tratamentul constipației, cosmetice etc..
PET-ul este utilizat la producerea tuturor tipurilor de recipiente de unică folosință, care sunt utilizate în diferite tipuri de băuturi și alimente. Poliuretanul este utilizat ca izolator termic în frigidere și ca umplutură în diferite tipuri de mobilier.
Explozivi
Este utilizat la fabricarea dinamitei, permițând ca prin scăderea punctului de îngheț al nitroglicerinei, să poată fi depozitată cu un risc mai mic..
Protectia lemnului
Etilen glicolul este utilizat în tratamentul lemnului pentru a-l proteja împotriva putregaiului său, produs de acțiunea ciupercilor. Acest lucru este important pentru conservarea operelor de artă ale muzeului.
Alte aplicatii
Etilenglicolul este prezent în mediu pentru suspendarea sărurilor conductoare în condensatoarele electrolitice și în stabilizatorii de spumă de soia. Este, de asemenea, utilizat la fabricarea plastifianților, elastomerilor și cerurilor sintetice.
Etilenglicolul este utilizat în separarea hidrocarburilor aromatice și parafinice. În plus, este utilizat la fabricarea detergenților pentru echipamentele de curățare. Crește vâscozitatea și scade volatilitatea cernelii, facilitând utilizarea acesteia.
De asemenea, etilen glicolul poate fi utilizat în turnătoria nisipului de turnare și ca lubrifiant în timpul măcinării sticlei și cimentului. Este, de asemenea, utilizat ca ingredient în fluidele de frânare hidraulice și ca intermediar în sinteza esterilor, eterilor, fibrelor de poliester și rășinilor..
Printre rășinile în care etilen glicolul este utilizat ca materie primă se numără alchida, utilizată ca bază a vopselelor alchidice, aplicată în vopselele auto și arhitecturale..
Intoxicații și riscuri
Simptome de expunere
Etilenglicolul are o toxicitate acută scăzută atunci când acționează prin contactul cu pielea sau dacă este inhalat. Dar, toxicitatea sa se manifestă pe deplin atunci când este ingerată, fiind indicată ca doză fatală de etilen glicol de 1,5 g / kg greutate corporală sau 100 ml pentru un adult de 70 kg..
Expunerea acută la etilen glicol produce următoarele simptome: inhalarea provoacă tuse, amețeli și cefalee. Pe piele, prin contactul cu etilen glicol, apare uscăciunea. Între timp, în ochi produce roșeață și durere.
Daune prin ingestie
Ingerarea etilenglicolului se manifestă prin dureri abdominale, greață, inconștiență și vărsături. Un aport excesiv de etilen glicol are un efect dăunător asupra sistemului nervos central (SNC), funcției cardiovasculare și morfologiei și fiziologiei rinichilor..
Datorită eșecurilor în funcționarea SNC, apare paralizie sau mișcare neregulată a ochilor (nistagmus). În sistemul cardiopulmonar, există tensiune arterială crescută, tahicardie și posibilă insuficiență cardiacă. Există modificări grave ale rinichiului, produs al otrăvirii cu etilen glicol.
Dilatarea, degenerarea și depunerea oxalatului de calciu apar în tubii renali. Acesta din urmă se explică prin următorul mecanism: etilenglicolul este metabolizat de enzima lactică dehidrogenază pentru a produce glicoaldehidă.
Glicoaldehida dă naștere la acizi glicolici, glioxilici și oxalici. Acidul oxalic precipită rapid cu calciu pentru a forma oxalat de calciu, ale cărui cristale insolubile sunt depozitate în tubii renali, producând alterări morfologice și disfuncții în acestea, care pot duce la insuficiență renală..
Datorită toxicității etilenglicolului, acesta a fost înlocuit treptat, în unele dintre aplicațiile sale, cu propilen glicol.
Consecințele ecologice ale etilenglicolului
În timpul degivrării lor, avioanele eliberează cantități semnificative de etilen glicol, care ajung să se acumuleze pe benzile de aterizare, care atunci când sunt spălate determină apa să transfere etilen glicolul, prin sistemul de drenaj, în râuri, unde toxicitatea acestuia afectează viața avionul.pește.
Dar toxicitatea etilenglicolului nu este în sine principala cauză a daunelor ecologice. În timpul biodegradării sale aerobe se consumă o cantitate semnificativă de oxigen, provocând scăderea acesteia în apele de suprafață.
Pe de altă parte, biodegradarea sa anaerobă poate elibera substanțe toxice pentru pești, cum ar fi acetaldehidă, etanol, acetat și metan..
Referințe
- Wikipedia. (2019). Etilen glicol. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. Baza de date PubChem. (2019). 1,2-Etandiol. CID = 174. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Etilenglicol: Structură, Formula și utilizări. Studiu. Recuperat de la: study.com
- Leroy G. Wade. (27 noiembrie 2018). Etilen glicol. Encyclopædia Britannica. Recuperat de pe: britannica.com
- A. Dominic Fortes și Emmanuelle Suard. (2011). Structuri cristaline de etilen glicol și etilen glicol monohidrat. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24 decembrie 2010). Procesul de producție și fabricație a etilenglicolului (EG). Recuperat de pe: icis.com
- Lucy Bell Young. (2019). Care sunt utilizările Etilenglicolului? Reactiv. Recuperat de la: chemicals.co.uk
- QuimiNet. (2019). Originea, tipurile și aplicațiile etilenglicolilor. Recuperat de pe: quiminet.com
- R. Gomes, R. Liteplo și M.E. Blând. (2002). Etilenglicol: Aspecte privind sănătatea umană. Organizația Mondială a Sănătății Geneva. [PDF]. Recuperat de la: who.int


Nimeni nu a comentat acest articol încă.